Publié le
Lecture 10 mins
La néphroangiosclérose en 2012
P. ZAOUI, CHU Grenoble
Les néphropathies vasculaires sont soit la conséquence de lésions des gros vaisseaux proximaux, éventuellement accessibles à des interventions directes (sténoses des artères rénales et de leurs branches), soit liées à des atteintes intrarénales distales des artères de moyen calibre (néphroangiosclérose proprement dite), des artérioles ou de l’endothélium glomérulaire (angéites et microangiopathies) (figure 1).
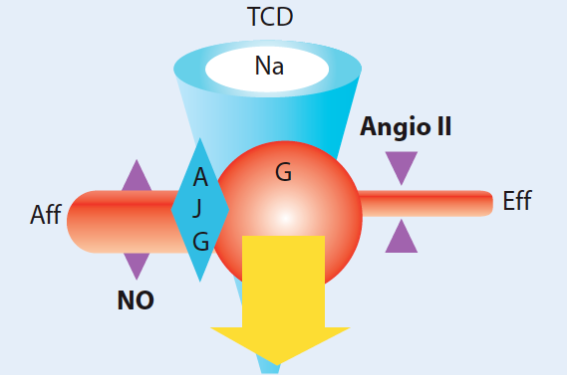
Figure 1. Étiologies des néphropathies vasculaires. L'homéostasie hydrosodée des mammifères terrestres nécessite une surface d’échange néphronique répartie en 600 000 à 1 million d’unités de filtration (néphrons) par rein (figure 2). Cette arborescence vasculaire ultrafiltre continuellement 120 l d’eau plasmatique par jour qui sont réabsorbés à 99 % dans le système veineux dans des conditions hémodynamiques extrêmement régulées (adaptation pression artérielle/natriurèse). De ce fait, les maladies rénales sont à la fois acteurs et victimes des maladies cardiovasculaires. Les marqueurs rénaux font partie intégrante du risque cardiovasculaire : la baisse de la clairance estimée (MDRD/Cockcroft), avant même l’élévation de la créatinine, ainsi que la présence d’une excrétion urinaire d’albumine pathologique doivent être reconnues et traitées comme des facteurs du risque cardiovasculaire absolu. Figure 2. Les principaux intervenants dans la filtration néphronique. Malgré les liens étroits entre HTA et néphropathies et l’effet aggravant du non-contrôle tensionnel sur la progression des néphropathies (ou la résistance de l’HTA dans les néphropathies qui progressent), le rôle de l’HTA dite « essentielle » dans l’étiopathogénie des néphropathies vasculaires et de l’insuffisance rénale chronique terminale (IRCT) des sujets âgés reste controversé. L’impact de l’HTA légère à modérée, lorsqu’elle est isolée, comme phénomène initiateur de lésions rénales repose sur des données fragiles. En particulier, il existe peu de modèles animaux d’HTA entraînant une insuffisance rénale sévère sans associer des lésions rénales surajoutées ou des modifications génétiques complexes. On peut regrouper les néphropathies vasculaires en 3 cadres nosologiques : • la néphroangiosclérose, maladie vasculaire primitive du rein ou conséquence de l’hypertension systémique sur le rein, organe-cible ; • la néphropathie ischémique, conséquence du remodelage vasculaire et tissulaire systémique, liée à l’athérome ; • les embolies de cholestérol, complications aiguës ou subaiguës, souvent associées à une néphropathie ischémique sous-jacente. Définition et épidémiologie des néphropathies vasculaires La néphroangiosclérose (NAS), ou néphropathie hypertensive, représente la première cause (22-30 %) d’insuffisance rénale terminale en France. À l’inverse, l’insuffisance rénale terminale représente moins de 0,5 % des événements annuels des hypertendus essentiels. Ces atteintes liées à une vasoconstriction/ ischémie rénale sont donc des maladies autonomes, probablement hétérogènes, formant un cadre séparé de l’HTA essentielle. La NAS représente un ensemble de lésions histologiques, la plupart non spécifiques, que l’on peut retrouver associées dans la progression des néphropathies, chez les sujets obèses, ou au cours du vieillissement. Malgré une clinique pauvre (baisse lente du MDRD, excrétion urinaire d’albumine et chiffres tensionnels modérément pathologiques), le contexte (âge, diabète, coronaropathie, artériopathie distale et cérébrale) est variable et le pronostic reste très réservé avec une survie en dialyse moins bonne que celle des autres néphropathies. Le diagnostic de NAS est fait, en général, par élimination et souvent par excès. Ces patients vasculaires, hypertendus et insuffisants rénaux sont probablement mal phénotypés ou trop tardivement explorés, à terrain génétique particulier, comme c’est le cas chez les Afro-Américains. L’HTA apparaît alors plus comme un facteur de gravité de la maladie vasculaire rénale sous-jacente que comme un élément initiateur ou de progression de la dégradation rénale. La très forte prévalence de NAS dans les populations d’origine africaine a permis d’isoler des variants géniques, sélectionnés car protecteurs de certaines parasitoses sub-sahariennes (MYH9-non muscle myosin/APOL1-Apolipoprotein L1), fortement associés au risque d’insuffisance rénale terminale. Cependant, leur activité biologique et leur rôle physiopathologique (inflammation, biologie de la cellule musculaire lisse, de l’endothélium ou du podocyte) restent à élucider. Le traitement fait appel préférentiellement aux bloqueurs du système rénine-angiotensine et le schéma d’adaptation posologique doit inclure non seulement la réponse tensionnelle, mais aussi la réponse rénale en termes de MDRD (tolérance) et d’excrétion urinaire d’albumine (efficacité). Une cible tensionnelle plus basse que les recommandations récentes concernant HTA et diabète, 135/80, voire 130/80 mmHg, bien que moins solidement établie, pourrait être bénéfique chez les sujets à risque, en particulier lorsqu’ils sont détectés au stade précoce de la maladie rénale chronique par une baisse inexpliquée du MDRD ou par une excrétion urinaire d’albumine qui augmente (tableau ci-dessous). SRA et débit de filtration glomérulaire Le fonctionnement néphronique est autorégulé pour permettre de maintenir une filtration glomérulaire et des processus tubulaires adaptés aux besoins de l’organisme. La pression intraglomérulaire (dépendant du niveau de vasoconstriction intrarénal) et la fraction filtrée de Na (élément de régulation de la volémie) sont éminemment modulables. L’élément senseur, l’appareil juxtaglomérulaire (AJG), sensible à la pression intraglomérulaire et à la concentration en Na du tube contourné distal au contact, définit le niveau de sécrétion de rénine active. Le débit de filtration glomérulaire (G) dépend de la différence de pression entre artériole afférente (Aff) et efférente (Eff) (loi de Starling) par un équilibre entre médiateurs vasodilatateurs (NO, bradykinine) et vasoconstricteurs (angiotensine II, production paracrine et endocrine de rénine par l’AJG). L’ultrafiltrat (eau, Na) sera réabsorbé dans le tubule sous l’influence de l’angiotensine II et de l’aldostérone. La concentration de Na dans le tube contourné distal (TCD) joue un rôle de feedback pour contrôler la production de rénine glomérulaire et la pression de filtration (figure 3). Figure 3. Schéma de régulation de la filtration glomérulaire. La production d’angiotensine II a deux objectifs physiologiques : – maintien de la pression de filtration glomérulaire (vasoconstriction artériole efférente) ; – maintien de la volémie (réabsorption tubulaire Na et H2O) (figure 4). Figure 4. Rôle physiologique du système rénine-angiotensine. Histoire naturelle de la néphroangiosclérose (NAS) On parle généralement de néphroangiosclérose « bénigne », en opposition à l’HTA/NAS maligne du fait de la proximité des lésions rénales, mais l’âge plus avancé, l’évolution sur plusieurs années et la présence de lésions d’athérome dans d’autres territoires, rapprochent davantage la NAS conventionnelle des néphropathies ischémiques que de la NAS maligne, plus inflammatoire, plus proche des vascularites et de la sclérodermie. Circonstances de découverte Les données récentes concernant le fond génétique (haplotype de risque MYH9) des Afro-Américains, hypertendus et/ou diabétiques insuffisants rénaux, suggèrent une susceptibilité rénale particulière à l’HTA, voire une maladie rénale primitive. Il faut donc différencier précocement les sujets à risque rénal des autres patients dont les lésions rénales sont consécutives à l’HTA et à l’athérome. Ce label non spécifique a été largement appliqué aux patients afro-américains insuffisants rénaux non diabétiques, sans biopsie rénale, porteurs d’une HTA découverte en même temps que la maladie rénale et souvent associée à une HVG rapide. La protéinurie est souvent présente, à taux variable, mais insuffisamment recherchée, généralement 2,5 g/l. Il faut penser à une NAS devant : – un sujet âgé (même en l’absence d’HTA), – une HTA « essentielle », – un diabète, – des néphropathies chroniques (50 %). Diagnostic La fréquence de la néphroangiosclérose est d’appréciation difficile et son impact en tant que cause d’insuffisance rénale terminale est variable selon les séries. Le retentissement sur le rein, organe-cible de l’HTA essentielle, nécessite idéalement une documentation histologique par biopsie. C’est plus souvent a posteriori, sur des antécédents anciens d’HTA, la découverte d’une élévation progressive de la créatinine sanguine associée ou non à une microalbuminurie ou à une protéinurie glomérulaire, en dehors de pathologies rénales authentifiées (congénitale, infectieuse, glomérulonéphrite, diabète), qui fait suspecter le diagnostic associant 3 critères majeurs : – débit de filtration rénale (DFG) pathologique, – microalbuminurie, – ponction-biopsie rénale. Histologie La NAS atteint les artères intrarénales de petit calibre et les artérioles (préglomérulaires, interlobulaires et arquées). C’est l’augmentation progressive de la paroi artérielle associée à la réduction du calibre de la lumière en 5 stades selon la classification de Sommers (figure 5). Ce remodelage vasculaire est la conséquence des adaptations pariétales à l’augmentation du régime des pressions dans l’arbre vasculaire rénal. Il faut cependant garder en mémoire que cet épaississement artériolaire intrarénal n’est pas corrélé et semble préexister à l’HTA systémique. Figure 5. Classification de Sommers. Lésions histologiques élémentaires - Hyalinose sous-endothéliale - Hyperplasie myo-intimale (bulbe d’oignon = NAS maligne) - Nécrose fibrinoïde artériolaire (NAS maligne) - Glomérules ischémiques - Atrophie tubulaire - Fibrose interstitielle inflammatoire Les biopsies de ces patients révèlent, en plus des lésions vasculaires, une sclérose globale ou segmentaire des glomérules dits « ischémiques », aux basales épaissies, associée à une fibrose interstitielle sévère avec des tubes atrophiques et des infiltrats de cellules inflammatoires en bandes, probablement séquellaires d’épisodes prolongés de vasoconstriction médullaire comme on l’observe dans l’analyse des lésions d’insuffisance rénale aiguë sous bloqueurs du SRA (MA. Onuigbo). Entité clinique : néphropathie hypertensive - Fréquence ? 30 % causes IRT USA. Diagnostic d’élimination. -
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante