Publié le
Lecture 16 mins
L’angioplastie artérielle au CO2 : pourquoi et comment faire du neuf avec du vieux ?
Jean-Marc PERNÈS, Costantino Del GIUDICE, unités de cardiologie et de radiologie interventionnelles, Institut Mutualiste Montsouris, Paris
L’extension des indications d’angioplastie artérielle périphérique est une réalité. La technique s’applique à présent à des patients de plus en plus âgés et présentant de nombreuses comorbidités.
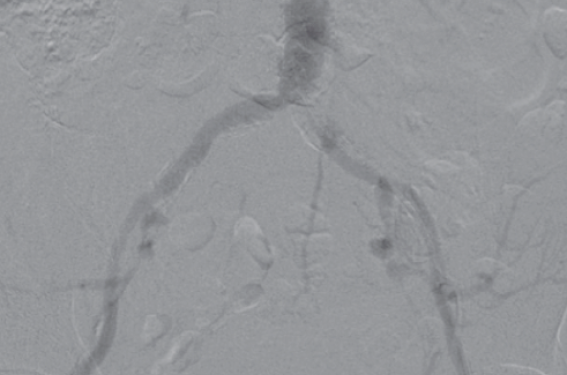
RATIONNEL D’EMPLOI DU CO 2 COMME AGENT DE CONTRASTE INTRAVASCULAIRE Les produits de contraste iodés (PCI) constituent l’agent d’opacification artérielle de référence, mais leur injection peut se compliquer de néphropathie avec parfois des lésions rénales irréversibles (1). Même si les PCI ne doivent plus être considérés comme les seuls responsables de la toxicité rénale, qui ne survient le plus souvent qu’en présence de facteurs associés, – on a remplacé l’expression insuffisance rénale aiguë (IRA) induite par le contraste par celle d’IRA postcontraste –, cette néphrotoxicité n’est pas rare après une intervention endovasculaire cardiovasculaire pouvant toucher jusqu’à 15 % des patients (2) et elle est grevée d’une augmentation de la mortalité (22 % vs 1,4 % de mortalité intrahospitalière (3)). La stratégie la plus efficace pour réduire le risque toxicité rénale est, d’une part la prévention par l’hydratation parentérale pré et perprocédure et, d’autre part, la limitation de la quantité de PCI injecté ( à 4 ml/kg) (4)). Les autres complications de l’utilisation de PCI sont les réactions d’hypersensibilité graves, dites « spécifiques », de nature immunologique vraie, certes rarissimes, mais qui demeurent une authentique problématique dans la réalité. Enfin, au-delà des contre-indications potentielles de l’utilisation des PCI se pose la question de l’impact économique sur les coûts hospitaliers de l’emploi des PCI et de l’intérêt de rechercher des alternatives avec un meilleur rapport coût-efficacité. L’utilisation de dioxyde de carbone (CO 2), produit endogène dépourvu de phénomènes de néphrotoxicité et allergiques (5), est une alternative valable en angioplastie artérielle périphérique, offrant une bonne qualité d’imagerie avec un risque de complications liés à son utilisation très faible et à un coût incomparable. L’angiographie au CO 2 peut être utilisée comme modalité d’imagerie seule ou comme agent adjuvant pour minimiser la quantité de PCI requise pendant l’intervention réelle (5,6). HISTORIQUE DE L’UTILISATION DE CO 2 EN IMAGERIE L’utilisation de CO 2 en imagerie remonte au début du XX e siècle où, initialement, ce gaz a été utilisé dans l’imagerie du rétropéritoine. Par la suite, dans les années 1950, le CO 2 a été employé dans la détection des épanchements péricardiques et l’opacification veineuse. Ce n’est que dans les années 1970 qu’il a commencé à être injecté comme agent d’opacification artérielle à la suite des travaux de Hawkins (6). Irvin F. Hawkins, largement reconnu comme un pionnier de l’angiographie au CO 2 moderne, a décrit comment sa découverte lui a permis de réaliser le potentiel de cette technique lorsqu’il a injecté par inadvertance de l’air dans le tronc cœliaque, heureusement sans conséquences néfastes (n’nième exemple de sérendipité médicale !). Cette expérience, associée à sa connaissance de la sécurité du CO 2 en tant qu’agent de contraste intraveineux, l’a amené à envisager le CO 2 comme agent de contraste potentiel dans le système artériel. Ses premières expériences ont marqué le début de cette nouvelle approche pour l’imagerie intravasculaire mais malgré des propriétés prometteuses, sa diffusion a été limitée par la survenue de complications potentiellement graves, une qualité d’imagerie initialement insuffisante ainsi que la difficulté pour les opérateurs habitués à utiliser des agents d’opacification liquides à manier un agent gazeux. Une bonne connaissance des propriétés du CO 2 est donc nécessaire afin d’obtenir la meilleure qualité possible d’imagerie et minimiser le risque de complications (7) liées à la technique. PROPRIÉTÉS DU CO 2 ET CONSÉQUENCES EN IMAGERIE Absence de toxicité ou de réactions allergiques Le CO 2 est un agent neutre, naturel qui est non néphrotoxique, non hépatotoxique et non allergène. Clairance intravasculaire complète rapide Le CO 2 est très soluble dans le sang, avec un bolus intravasculaire de 30 ml de CO 2 se dissolvant complètement en 30 à 60 secondes. La majeure partie du CO 2 circulant est éliminée par les poumons en un seul passage. Il n’existe pas en théorie de limite de dose si un intervalle libre, laissant suffisamment de temps à son élimination, est respecté entre les injections ( 100 cc toutes les 2 minutes). Flottabilité : conséquences sur l’opacification La flottabilité est définie comme la tendance d’un corps à flotter quand il est immergé dans un fluide. Celle du CO 2 est élevée et il va flotter au-dessus du sang (figure 1). Cette caractéristique clé du CO 2 affecte grandement son utilisation correcte comme moyen d’imagerie vasculaire. Figure 1. Flottabilité élevée du CO 2. Par analogie avec l’injection d’hélium dans un arbre creux, le CO 2 va opacifier préférentiellement les branches les plus ventrales (il va « flotter » au-dessus du sang) et le sang va se retrouver dans les branches les plus dorsales. D’après Kyung J. Cho, Irvin F. Hawkins, Carbon dioxide angiography : principles, techniques, and practices, https://doi.org/10.3109/9781420016260). Ainsi, le sang va se retrouver préférentiellement dans une position plus déclive que le CO 2 (régions du corps dites « dépendantes » de la gravité qui sont les plus dorsales) et le CO 2 dans une position plus proclive (régions dites « non dépendantes » de la gravité qui sont les plus ventrales). Ainsi, la qualité d’opacification des vaisseaux va varier en fonction de leur localisation ventrale ou dorsale. Comme le CO 2 va se retrouver préférentiellement sur les régions ventrales, le remplissage sera meilleur au niveau des artères du tronc cœliaque, mésentérique supérieure, mésentérique inférieure, plutôt que dans les artères rénales et hypogastriques. De la même manière, en ce qui concerne les extrémités, la mise en position de Trendelenburg avec surélévation des membres inférieurs de 15-20 va améliorer leur remplissage, le CO 2 allant se loger dans les régions les plus ventrales. Les précautions à prendre en conséquence à cette flottabilité élevée du CO 2 sont de ne pas réaliser d’injection en décubitus ventral en raison du risque d’ischémie médullaire par passage du CO 2 dans les artères médullaires et de ne pas réaliser d’injection tête surélevée car le CO 2 peut flotter à contre-courant jusqu’à la circulation cérébrale ; cette propriété explique le risque de piégeage du CO 2 dans une structure anatomique ventrale (artère pulmonaire, anévrisme de l’aorte abdominale). Viscosité ultra faible/diffusibilité élevée Le CO 2 a une viscosité très faible, 400 fois inférieure à celle d’un PCI, ce qui permet une injection manuelle facile à travers des cathéters de petit calibre. Un volume de CO 2 suffisant pour l’imagerie aortique peut être facilement injecté manuellement à l’aide d’un cathéter de diagnostic multitroué, 3 ou 4 F. Les propriétés gazeuses du CO 2 entraînent un reflux central depuis le point d’administration. Cela permet une excellente évaluation de la maladie ostiale sans avoir besoin d’une angiographie de retrait de cathéter ou d’obliquités multiples. Cette caractéristique est très avantageuse lors d’interventions ostiales telles que la pose d’endoprothèses rénales et mésentériques. Le CO 2 est 20 fois plus soluble que l’air, le rendant beaucoup moins occlusif. Il est transporté dans le sang principalement sous forme d’ions bicarbonate. En administration intravasculaire, il est dissous en 30-60 secondes. S’il persiste au-delà de ce délai, il faut suspecter une contamination par l’air ou bien un piégeage ( trapping) dans une structure anatomique. Non miscibilité et déplacement de liquide Lors de son injection intravasculaire, le CO 2 déplace le sang au lieu de se mélanger à celui-ci. Ainsi, contrairement au PCI, il ne subit pas de dilution progressive, ce qui permet une excellente visualisation des veines centrales et d’autres structures vasculaires de grande taille et de grande capacité. La quantité de CO 2 à injecter devra être suffisante afin de provoquer un déplacement complet de la colonne sanguine. Ainsi, celle-ci va dépendre de la taille du vaisseau à opacifier (plus le vaisseau à opacifier est grand, plus grande devra être la quantité injectée), pouvant atteindre jusqu’à 100 cc pour une aortographie (figure 2). Si le volume de CO 2 injecté est insuffisant, la colonne sanguine va être déplacée de manière incomplète, conduisant à une sous-estimation du calibre du vaisseau (figure 3). Les vaisseaux de taille inférieure à 10 mm, sont mieux opacifiés par le CO 2 que les vaisseaux plus gros (8). Figure 2. Aortographies au CO 2. A : Opacification moins bonne des hypogastriques en raison de leur naissance postérieure. B : Image artefactée par l’interposition des gaz digestifs. L’utilisation de glucagon par voie IV, diminuant le péristaltisme, peut améliorer l’imagerie. Figure 3. Le CO 2 déplace la colonne sanguine sans se mélanger avec le sang. AMS : artère mésentérique supérieure. AMI : artère mésentérique inférieure. Incolore et inodore C’est une caractéristique indésirable du CO 2 qui le rend impossible à distinguer visuellement de l’air. Par conséquent, une mauvaise application des mesures de protection peut entraîner une contamination de l’air, avec de graves complications (phénomènes d’embolisation gazeuse). Cette contamination par l’air survient rapidement (figure 4) en raison de la diffusion rapide du CO 2 et de la grande différence de pression partielle entre le système d’injection et l’atmosphère (CO 2 dans l’atmosphère 0,03 %, CO 2 dans la seringue 99,9 %). Ainsi en cas d’utilisation d’un système d’injection en contact avec l’atmosphère (une seringue), le CO 2 va très vite diffuser à l’extérieur de la seringue et va être remplacé par de l’air à une vitesse de 0,2 cc/s (soit jusqu’à 2 cc en 10 s) (9) d’où la nécessité d’utiliser un système de délivrance clos. Figure 4. Le CO 2 est remplacé par de l’air à une vitesse de 0,2 cc/s. Contamination par l’air du système d’injection non détectable en raison de l’invisibilité du CO 2 avec un risque d’embolie gazeuse
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante