Publié le
Lecture 14 mins
Intérêt de la génétique dans la mort subite sur cœur apparemment sain
F. SACHER, Hôpital cardiologique du Haut-Lévêque, université Bordeaux-II, C. ROORYCK-THAMBO, Service de génétique médicale, CHU de Bordeaux
L’intérêt de la génétique dans la mort subite familiale ne se résume pas à la recherche d’une mutation. Elle permet l’identification et la prévention des personnes à risque dans la famille. Pour cela, la cause de la mort subite doit être recherchée, une enquête familiale réalisée et enfin pour certaines pathologies on cherchera une mutation génétique.
Cette mise au point se limite aux morts subites rythmiques sur cœur sain.
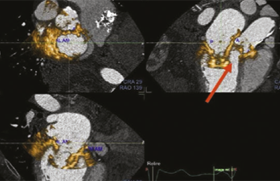
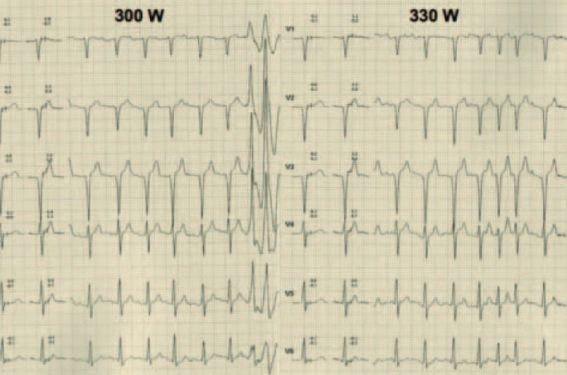
Rechercher l’étiologie de la mort subite Il s’agit d’une étape essentielle pour la suite de la prise en charge car les causes de mort subite sont multiples, et loin d’être toutes héréditaires (infarctus du myocarde, embolie pulmonaire, rupture d’anévrisme...). De plus, l’identification de l’étiologie permet une meilleure acceptation du décès, et ce qui était vécu comme une fatalité devient la conséquence d’une pathologie. Si le patient est décédé, il faut récupérer le compte rendu d’autopsie, et demander du matériel biologique s’il est disponible (parfois possible si des prélèvements toxicologiques ont été réalisés par la justice et si le décès est très récent) pouvant servir à une analyse génétique ultérieure. Les circonstances du décès sont également primordiales à recueillir (âge lors du décès 45 ans, circonstances de survenue - repos, sommeil, effort -, douleurs thoraciques avant le décès, facteurs de risque cardiovasculaire, autres morts subites dans la famille, âge lors de ces morts subites). Tous ces éléments permettront d’orienter le diagnostic, donc de proposer une enquête familiale appropriée. S’il s’agit d’un patient avec mort subite récupérée, les choses sont plus « simples », et le patient bénéficie d’un bilan complet : interrogatoire à la recherche des mêmes éléments que ci-dessus pour orienter le diagnostic, ECG, Holter-ECG longue durée, échocardiographie et épreuve d’effort. Puis, en fonction du contexte et des premiers résultats, on pourra réaliser des tests pharmacologiques (ajmaline, adrénaline, iso-prénaline), une coronarographie et une IRM cardiaque (forme fruste DAVD, CMH apicale, non-compaction). La recherche d’une mutation génétique n’est réalisée que lorsqu’un diagnostic permettant d’orienter l’analyse génétique est posé. Enquête familiale Elle est indispensable en cas de mort subite (récupérée ou non) liée à une pathologie rythmique héréditaire afin de prévenir un autre décès dans la famille. Les formes familiales identifiées sont principalement de transmission autosomique dominante (avec des sujets, hommes ou femmes, atteints à chaque génération - transmission dite « verticale »), mais il existe aussi des formes de transmission autosomique récessive (apparition de la pathologie dans une génération donnée chez plusieurs descendants, transmission dite « latérale » dans l’arbre généalogique). Dans le cas d’une transmission autosomique dominante, le dépistage familial doit commencer par les apparentés ascendants et descendants du 1 er degré du cas index (1) (père, mère, et enfants en fonction de leur âge et de la pathologie identifiée), puis en fonction des résultats obtenus chez les parents du cas index, le dépistage se poursuit chez les frères, sœurs, oncles et tantes du cas index, et continue de proche en proche (figure 1). Autant l’enquête familiale est souvent réalisée lorsque le patient survit et est hospitalisé en cardiologie autant lorsque le décès survient en dehors de l’hôpital voire dans un service de réanimation médicale non sensibilisé à ce problème, elle est rarement proposée à la famille. Arbre généalogique Figure 1. Patient de 27 ans (III-1) asymptomatique jouant en fédérale 1 de rugby vu pour la visite médicale habituelle de début de saison. Le médecin est interpellé par la mort subite de son grand-père à 41 ans et par le fait que son père et 2 de ses oncles sont implantés d’un défibrillateur pour une myocardiopathie dilatée à coronaires saines. En poussant plus loin les investigations, le diagnostic de laminopathie avec mutation dans le gène de la lamine A/C sera porté chez eux et la mutation sera également retrouvée chez le sujet III-1. Absence de pathologie identifiée Si aucune pathologie n’a pu être identifiée chez la personne décédée, mais qu’on pense à une pathologie héréditaire, alors les circonstances de survenue du décès sont essentielles à faire préciser (cf. chapitre précédent). Pour l’apparenté venant consulter, on commence toujours par un interrogatoire à la recherche de syncopes ou équivalents (respiration agonique nocturne, crise tonico-clonique...). On pratique ensuite un ECG 12 dérivations en continu avec manœuvres de Valsalva, puis en remontant les électrodes de 2 espaces intercostaux (V1 et V2 au 2 e espace intercostal) pour améliorer la détection d’un syndrome de Brugada (2). En fonction du contexte clinique (cf. infra - description des différentes pathologies rythmiques héréditaires) et de l’aspect ECG, on oriente les examens. Toutefois, le bilan de première intention comprend généralement une échocardiographie (bien que très rarement contributive dans ce contexte), un Holter-ECG (pour identifier la survenue de trouble du rythme - exceptionnel -, mais surtout les changements morphologiques de QRS et de longueur de QT, en particulier la nuit) et une épreuve d’effort (d’autant plus intéressante que les morts subites familiales surviennent dans un contexte adrénergique ou en cas de suspicion de QT long - non-raccourcissement à l’effort). Ensuite, en fonction des données recueillies, on peut proposer un test aux bloqueurs des canaux sodiques (ajmaline, flécaïne, procaïnamide) si l’aspect ECG est suspect de Brugada ; un test à l’isoprénaline (3), si contexte catécholergique ; un test à l’adrénaline (4,5) (figure 2), si suspicion de QT long ; une IRM si suspicion de DAVD ou de myocardiopathie débutante. Figure 2 . Protocole pour la réalisation du test à l’adrénaline en cas de suspicion de QT long et d’intervalle QT limite. Syndrome du QT long Il s’agit d’une entité regroupant des pathologies différentes (> 10 formes) ayant en commun un allongement de l’intervalle QT corrigé supérieur à 440 ms chez les hommes et 460 ms chez les femmes. Les trois premières formes décrites de ce syndrome représentent la grande majorité des formes retrouvées (70-80 %). Le QT long de type 1 (environ 40 % des syndromes du QT long) est caractérisé par une onde T large avec une pente ascendante lente et surtout par la survenue fréquente de syncope à l’effort, tout particulièrement en nageant. Toute syncope en piscine doit faire évoquer la possibilité d’un QT long. Il répond particulièrement aux bêtabloquants qui permettent de diminuer très nettement le risque de mort subite. Il est rare de devoir recourir à l’implantation d’un défibrillateur. Le dépistage familial dans cette forme requiert outre l’ECG, un Holter-ECG (variations de la longueur du QT sur les 24 heures) et une épreuve d’effort (absence de raccourcissement du QT à l’effort). En cas de doute persistant, on peut réaliser un test à l’adrénaline (figure 3) qui permet de porter le diagnostic avec une sensibilité de 91 % et une spécificité de 100 % (4). Il est dû à une mutation dans le gène KCNQ1 entraînant une perte de fonction du canal potassique lent (Iks). Le QT long de type 2 (environ 30 % des syndromes du QT long) est caractérisé par une onde T bibosse. Les arythmies ventriculaires surviennent préférentiellement lors de stress émotionnel ou auditif (réveil, sonnerie de téléphone), mais parfois également à l’effort. Le traitement bêtabloquant est un peu moins efficace que pour le QT long de type 1, et il faut parfois recourir à l’implantation d’un défibrillateur automatique implantable (DAI). Les mêmes examens que pour le QT long de type 1 doivent être réalisés avec un intérêt particulier pour le Holter-ECG car la durée du QT est souvent variable au cours du temps. Il est dû à une mutation dans le gène KCNH2 entraînant une perte de fonction du canal potassique rapide (Ikr). Le QT long de type 3 représente environ 10 % des syndromes du QT long, mais cette forme possède le risque rythmique le plus élevé. La mort subite est fréquemment le mode d’entrée dans la maladie. Les arythmies ne semblent pas liées à une décharge catécholergique, et l’efficacité des bêtabloquants est controversée chez des sujets qui sont, en plus, souvent bradycardes à l’état basal. Il est fréquent de devoir implanter un DAI. Cette forme est due à une mutation dans le gène SCN5A entraînant un gain de fonction du canal sodique entrant. Le syndrome du QT long de type 7 (syndrome d’Andersen-Tawil) est rare, mais il a des caractéristiques très particulières. Il associe une dysmorphie faciale (hypoplasie mandibulaire, hypertélorisme, oreilles bas implantées, petite taille et parfois clinodactylie et syndactylie des doigts et/ou des orteils), une paralysie périodique (douleur musculaire à type de crampes par moment) et des signes ECG caractéristiques. Le QT est long, mais aux dépens d’une onde U proéminente (aspect pseudo-bibosse), par ailleurs il existe des ESV polymorphes fréquentes et parfois des TV bidirectionnelles (figure 3) relativement lentes et bien tolérées. Le risque de mort subite semble relativement faible chez les patients sous bêtabloquants, même s’ils ne font pas disparaître les troubles du rythme ventriculaire. Cette forme est due à une mutation dans le gène KCNJ2 dans la majorité des cas qui entraîne une perte de fonction du canal potassique Kir 2.1. Figure 3. TV bidirectionnelle (astérisques) quasi permanente chez un enfant de 9 ans asymptomatique atteint d’un syndrome de QT long de type 7 (Andersen-Tawil). Il est parfois difficile d’observer l’intervalle QT et l’onde T car les arythmies sont très fréquentes. Il existe parfois un bigéminisme polymorphe. La morphologie de l’onde T est très particulière avec un aspect de pseudo-bibosse souvent liée à une onde U proéminente (flèche). Tachycardies ventriculaires catécholergiques Elles se caractérisent par un risque élevé de mort subite chez les sujets jeunes typiquement à l’effort, les bêtabloquants représentent donc le traitement de choix au long cours (6). Elles sont parfois confondues avec une épilepsie chez l’enfant, ce qui peut être dramatique. L’ECG de base est normal, mais la survenue de troubles du rythme ventriculaire bidirectionnels et polymorphes à l’effort est caractéristique, même si à l’âge adulte ces troubles du rythme peuvent être moins marqués. L’épreuve d’effort est
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page précédente
- Page 2
- Page suivante