Publié le
Lecture 11 mins
Stress oxydant et diabète : mythe ou réalité ?
J.-L. SCHLIENGER, Professeur honoraire, Faculté de médecine de Strasbourg
Le stress oxydant (SO) figure en bonne place parmi les mécanismes impliqués dans la pathogénie de diverses maladies chroniques, dont le diabète. Bien que ses méfaits soient bien identifiés, le SO reste difficile à évaluer et, surtout, à intégrer dans une stratégie thérapeutique pertinente. Une visite au pays des prooxydants et des antioxydants s’impose.
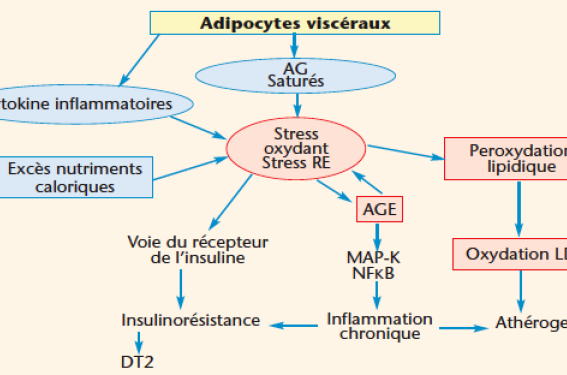
Radicaux libres et EROs Le métabolisme aérobie normal produit des espèces réactives de l’oxygène (EROs) qui incluent les radicaux libres (RL) prooxydants de l’oxygène (molécule contenant un électron non apparié) et certains dérivés oxygénés non radicalaires très réactifs. Leur demivie est brève du fait d’un système de défense permettant de piéger et de neutraliser ces molécules. La production et la régénération d’antioxydants qui déterminent la capacité antioxydante du sérum permettent d’établir un équilibre redox entre les prooxydants et les antioxydants, condition nécessaire pour bénéficier des effets positifs des EROs et empêcher leur action oxydative délétère sur les biomolécules, les cellules et les tissus. La consommation d’oxygène étant continue, le besoin en antioxydants l’est également (1). L’oxygène, qui comporte naturellement 2 électrons « célibataires » sur la couche périphérique, est très instable. Il en est de même des RL qui regroupent des molécules porteuses d’un électron « célibataire ». Cette propriété en fait des réactifs puissants qui ont tendance à oxyder les composés de rencontre auxquels ils arrachent un électron pour l’apparier à l’un des électrons célibataires avec pour conséquence une déstabilisation de ces composés et l’initiation d’une véritable réaction en chaîne de peroxydation. Elle ne s’interrompt qu’en présence de « piégeurs » des RL ou à la suite de la recombinaison de deux RL. L’anion superoxyde O2-, archétype du RL très agressif, produit des peroxydations à l’encontre des acides gras polyinsaturés (AGPI). Son action est neutralisée par la superoxyde dismutase (SOD) qui relie 2 anions pour produire de l’O2 et de l’H2O2 moins toxiques. Environ 2 % de l’oxygène est transformé en radicaux superoxydes dans la chaine respiratoire mitochondriale (tableau 1). Effets des RL Chez les sujets en bonne santé, les RL accomplissent des fonctions physiologiques. Les EROs interviennent dans le développement en tant que molécules de signalisation, participent à la modulation de la plasticité synaptique et font partie intégrante des mécanismes de défense contre toute agression extérieure, qu’elle soit infectieuse ou chimique en facilitant, entre autres, les mécanismes de phagocytose. Les EROs activent le signal apoptotique, phénomène naturel se produisant durant le développement normal. Le SO Le stress oxydant est une perturbation de l’équilibre redox responsable de dommages oxydatifs des biomolécules et d’une perturbation du fonctionnement cellulaire. Il est secondaire à une production radicalaire excessive et/ou une élimination insuffisante des EROs. La peroxydation des acides gras polyinsaturés des membranes et des lipoprotéines en est l’une des conséquences remarquables. L’oxydation des bases nucléiques et la coupure des brins exposent au risque de mutagenèse. L’oxydation des protéines par un processus irréversible de carbonylation se traduit par une perte fonctionnelle et l’apparition de produits avancés de la glycation (AGE). La liaison des AGE à leurs récepteurs cellulaires détermine l’activité de la MAP-kinase (Mutagen- Activated Protein kinase) et des facteurs de transcription sensibles à l’équilibre redox comme le NFκB qui stimule en retour la production d’EROs. Enfin le SO semble être l’un des mécanismes essentiels du vieillissement. Lorsqu’il est aigu, le SO détermine l’activation réversible de diverses protéines impliquées dans la métainflammation comme les protéines kinases (MAP-K) et des facteurs de transcriptions (NFκB) et des protéines phosphatases. Le SO induit les gènes exprimant les enzymes de réparation des lipides et de l’ADN, des antioxydants enzymatiques, des cytokines et des protéines du choc thermique. Cette réponse adaptative au SO peut favoriser une prolifération cellulaire aberrante, le maintien de fonctions normales ou déterminer une cytotoxicité avec lyse cellulaire. Production des EROs Les principaux facteurs majorant la production des RL sont l’âge, le tabagisme, la consommation excessive d’alcool, l’exposition au soleil et une alimentation hyperénergétique et à densité nutritionnelle basse. Un dysfonctionnement mitochondrial, l’inflation du stock ferreux qui est un prooxydant, un déficit relatif en micronutriments et l’insulino-résistance sont d’autres facteurs de production. Le rôle de l’alimentation est fondamental. Toute surcharge énergétique détermine une augmentation de l’oxydation mitochondriale, une inflammation de bas grade, un stress du réticulum endoplasmique et des perturbations endocriniennes, tel l’hyperinsulinisme. Parmi les nutriments apportés en excès, ce sont les acides gras saturés qui sont les plus nocifs. Globalement un régime alimentaire à densité énergétique faible et à densité nutritionnelle élevée (riche en fruits et légumes et en céréales complètes et pauvre en graisses et en glucides simples) est associé à une bonne capacité antioxydante du sérum. Estimation du SO L’évaluation du niveau de SO est réalisable mais l’interprétation au plan individuel est toujours délicate. Les résultats ne rendent compte que d’un instantané. Parmi les approches possibles figure en bonne place l’estimation par un score combinant des facteurs d’exposition au risque, des marqueurs cliniques et des marqueurs biologiques. Les indications gagnent toujours à être confrontées à un état des lieux alimentaire et d’hygiène de vie ainsi qu’à un bilan biologique standard. Une autre approche consiste à mesurer les éléments biologiques de la défense radiculaire : taux plasmatique des piégeurs de RL comme les vitamines E et C et les caroténoïdes (α- et β-carotène, lutéine, lycopène, zéaxanthine), mesure des défenses enzymatiques dont la SOG et la GLTPx. Il est aussi possible d’estimer la capacité antioxydante totale du sérum. Enfin la mesure des marqueurs de l’oxydation des tissus cibles peut se faire par divers dosages : isoprostanes (métabolites terminaux de l’acide arachidonique), lipoparticules LDL oxydées, taux d’hydroxy- peroxydes et d’aldéhydes par la technique TBAR (Thiobarbituric Acid Reactant substances), produits de la glycation avancée et protéines carbonylées, évaluation des bases oxydées de l’ADN… Il n’y a pas lieu de promouvoir ce type de mesures chez des sujets sains dans une optique d’action préventive. La mesure du SO dans le cadre d’une pathologie n’a pas d’indication en dehors d’un protocole de recherche. L’estimation du SO par une méthode autre qu’estimative – portant sur le contexte, les habitudes de vie et l’alimentation – n’a guère d’intérêt en pratique clinique. SO et pathologie métabolique De très nombreuses situations impliquent le SO en tant que cause ou conséquence (tableau 2). Il participe directement à l’altération fonctionnelle cellulaire et tissulaire mais l’analyse des effets des EROs ou des ERNs (espèces réactives de l’azote) est difficile parce qu’ils dépendent de leur concentration dans la cellule. Le SO favorise les phénomènes inflammatoires qui sont encore amplifiés par les AGE et perturbe de nombreuses voies de signalisation dont les RL sont des éléments indispensables. Obésité L’augmentation du SO dans l’obésité illustre l’importance de son origine nutritionnelle. Considérée comme un facteur indépendant de SO, l’obésité rassemble un ensemble de situations qui en sont la cause ou la conséquence et qui sont liées à la graisse viscérale : inflammation chronique, insulinorésistance, dysfonctionnementdysfonctionnement endothélial, oxydabilité accrue des lipoprotéines… L’altération du statut antioxydant est corrélée à l’IMC mais il est difficile d’établir la part de l’impact direct du SO sur les composantes de l’adiposopathie (2). Syndrome plurimétabolique Le SOse trouve au coeur des mécanismes impliqués dans le syndrome métabolique. Les marqueurs plasmatiques et urinaires de SO sont plus élevés chez les sujets qui en sont atteints et sont corrélés au tour de taille. L’insulinorésistance, pivot physiopathologique du syndrome, est à la fois une cause et une conséquence du SO. Des données expérimentales et cliniques sont en faveur d’une relation inverse entre la sensibilité à l’insuline et le taux d’EROs. Les répercussions sur les grandes fonctions cellulaires, sur les organes comme le foie, sur l’inflammation, sur l’athérogenèse et sur la signalisation cellulaire (dont celle de l’insuline) sont vraisemblables mais difficiles à cerner de façon claire compte tenu de l’intrication des différents éléments en jeu. Dans ce schéma physiopathologique, les vitamines et éléments traces antioxydants pourraient jouer un rôle préventif et thérapeutique (figure). Modèle de l’obésité viscérale (syndrome plurimétabolique). Représentation schématique de la filiation entre les adipocytes viscéraux et les complications médiées par le stress oxydant et le stress du réticulum endoplasmique . RE : réticulum endoplasmique ; AGE : produits avancés de la glycation ; DT2 : diabète de type 2. Diabète L’hypothèse selon laquelle le SO est un acteur de la physiopathologie du DT2 est déjà ancienne et se fonde principalement sur la constatation d’une augmentation du SO et d’une saturation de la capacité de neutralisation des prooxydants dans le DT2. Ces anomalies débutent très tôt et s’aggravent avec le temps. L’hyperglycémie détermine par ellemême un état d’oxydation élevé avec des répercussions intracellulaires comme la phosphorylation et la déphosphorylation qui sont déterminées par le statut redox. Les apports excessifs de glucose sont métabolisés et oxydés par le cycle tricarboxylique, ce qui augmente le flux de NADH et de FADH2 (flavine adénosine dinucléotide) dans la chaîne de transport des électrons avec une accumulation en excès dans lecoenzyme Q conduisant à la synthèse de superoxydes. La peroxydation des lipides des membranes est proportionnelle à l’hyperglycémie. La génération directe des EROs par l’hyperglycémie accroît la formation des AGE intracellulaires, augmente le flux de la voie des polyols qui diminuent la NADPH, cofacteur essentiel du glutathion
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante



