Publié le
Lecture 17 mins
Cœur et adénosine
BaptisteMAILLE*/**, Régis GUIEU**, Pierre DEHARO*/** *CHU La Timone, service de cardiologie, Marseille **AMU, C2VN, Marseille
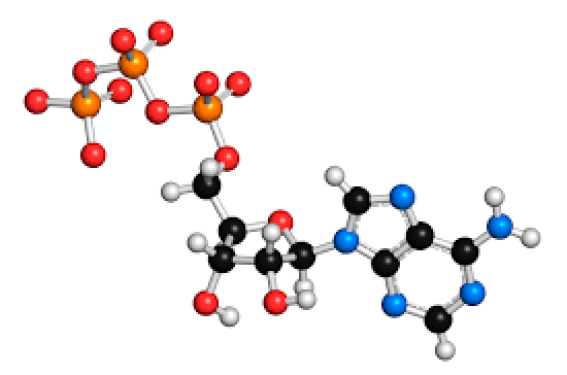
L’adénosine est synthétisée à partir de la déphosphorylation intracellulaire ou extracellulaire de l’adénosine triphosphate (ATP) via une nucléotidase, à partir du cycle de la méthionine intracellulaire, aboutissant à la synthèse d’homocystéine et d’adénosine ou encore à partir de la déphosphorylation intracellulaire de l’adénosine monophosphate cyclique (AMPc).
Métabolisme de l’adénosine (figure 1) Figure 1. Métabolisme de l’adénosine. Flèche bleue : action enzymatique conduisant à la synthèse de l’adénosine. Flèche marron : action enzymatique conduisant à la dégradation de l’adénosine. Flèche rouge : mécanisme d’action. ENT : transporteurs nucléosidiques équilibratifs ; SAH : S-adénosyl homocystéine ; SAM : S-adénosyl méthionine ; ATP : adénosine triphosphate ; AMPc : adénosine monophosphate cyclique. L’adénosine est synthétisée à partir de la déphosphorylation intracellulaire ou extracellulaire de l’adénosine triphosphate (ATP) via une nucléotidase, à partir du cycle de la méthionine intracellulaire, aboutissant à la synthèse d’homocystéine et d’adénosine ou encore à partir de la déphosphorylation intracellulaire de l’adénosine monophosphate cyclique (AMPc). Elle est libérée dans les espaces extracellulaires en particulier lors du stress oxydatif, de la baisse de la pression partielle en oxygène, lors de phénomènes ischémiques ou hypoxiques ou au cours des processus inflammatoires. Grâce aux transporteurs nucléosidiques équilibratifs les compartiments intra- et extracellulaires sont équilibrés. Ainsi l’augmentation intracellulaire du métabolisme énergétique ou la libération massive d’ATP extracellulaire, conduit à une augmentation intra- et extracellulaire de l’adénosine. Dans le sang, l’adénosine possède une demi-vie courte (30 s), car rapidement capturée par les globules rouges via le système de diffusion facilitée équilibratif, et également dégradée en inosine par l’adénosine déaminase, enzyme ubiquitaire ou encore rephosphorylée en ATP par l’action de l’adénosine kinase. En contexte d’hypoxie notamment, l’action de l’adénosine kinase est inhibée, ce qui entraîne donc une hyperadénosinémie. L’adénosine résiduelle (qui n’a été ni incorporée aux érythrocytes par diffusion facilitée ni désaminée) va agir sur un groupe de récepteurs qui lui sont propres, appelés A1, A2A, A2B, ou A3 ; cette fixation est fonction de la séquence primaire du récepteur et de leur affinité pour le ligand. L’activation des récepteurs A1 et A2A et A2B est responsable des principaux effets cardiovasculaires. Comme de nombreux récepteurs transmembranaires, le nombre de ces récepteurs est régulé par les variations de concentrations en adénosine. Adénosine et arythmies cardiaques Mécanismes électrophysiologiques La figure 2 illustre les différents effets de l’adénosine sur les potentiels d’actions intracardiaques, par activation directe du canal potassique I KADO, et inactivation indirecte du canal calcique lent I Ca,L. Concernant l’effet chronotrope négatif, celui-ci repose principalement sur l’activation des récepteurs A1, localisés en majorité au niveau du noeud atrio-ventriculaire (NAV), ou ils entraînent localement une hyperpolarisation et une diminution de l’amplitude du potentiel d’action. Il en résulte une diminution de l’automaticité, ainsi qu’un allongement des périodes réfractaires. Il s’agit du principe physiopathologique de base de l’apport de l’adénosine dans le diagnostic différentiel des tachycardies supra-ventriculaires, en entraînant un ralentissement puis un blocage transitoire de la conduction à travers le NAV. Cette action de l’adénosine via les récepteurs A1 est de courte durée et est dose dépendante. Figure 2. Effet de l’adénosine sur les différents potentiels d’action intracardiaques. Trait noir : potentiel d’action avant adénosine. Trait rouge : potentiel d’action après adénosine. *Activation directe du canal potassique IKADO ; # Inhibition indirecte du canal calcique ICaL. À l’étage atrial, l’action de l’adénosine a des effets électrophysiologiques différents. Le nombre de récepteurs A1 est plus faible ce qui explique l’effet chronotrope négatif moindre. Une fois les récepteurs A1 saturés, l’adénosine restante active alors les récepteurs A2A et A2B. À l’inverse des récepteurs A1, les récepteurs A2A et A2B, lorsqu’ils sont activés, induisent la production d’AMPC dans les cellules cibles via l’activation de l’adénélylcyclase (1). Ceci est responsable d’une diminution de la durée des potentiels d’action et d’une hyperpolarisation cellulaire (2). Ceci conduit à un raccourcissement des périodes réfractaires atriales (3). L’adénosine n’a pas d’action sur les cellules myocardiaques ventriculaires ou hissiennes. Injection d’adénosine dans les tachycardies supraventriculaires (4) Dans les tachycardies à QRS fins, le test à l’adénosine est utilisé en pratique courante à but diagnostique, et parfois thérapeutique lorsqu’elle permet l’arrêt de la tachycardie. Le tableau 1 illustre les différentes réponses attendues au test à l’adénosine en fonction de la tachycardie sousjacente. L’injection d’adénosine doit se faire en intraveineux le plus rapidement possible (posologie entre 6 et 18 mg/bolus), suivi d’un rinçage avec un soluté salin. En raison de la demi-vie courte de l’adénosine, sa durée d’action l’est également. Ainsi, les effets cliniques disparaissent totalement en 20-30 s et une nouvelle injection peut être envisagée 1 min après la précédente. L’injection d’adénosine triphosphate (posologie entre 20 et 30 mg/bolus), peut remplacer l’injection d’adénosine. L’injection d’adénosine peut provoquer dans de rares cas une bronchoconstriction, via l’activation des récepteurs A1, et doit être utilisée avec prudence chez les patients asthmatiques. Les autres effets indésirables attendus sont la survenue d’une bouffée de chaleur, d’une hypotension artérielle et d’une hyperventilation. Son mécanisme d’action sur les tachycardies à QRS fins est principalement médié par l’effet chronotrope négatif ( via A1 R) sur le NAV, mais aussi à moindre échelle sur le nœud sinusal et sur les myocytes atriaux. Elle n’a aucun effet sur une potentielle voie accessoire et doit être utilisée avec prudence dans toutes les tachycardies préexcitées, puisqu’en inhibant la conduction dans les voies normales, elle favorise le passage dans la voie accessoire et augmente le risque d’arythmies ventriculaires malignes. Reconnexion des conductions dormantes post-ablations Plusieurs études sur l’animal (2) et sur l’homme (5,6) ont montré que l’isolation électrique des veines pulmonaires en radiofréquence entraînait une dépolarisation cellulaire. Ainsi, il existe une élévation du potentiel membranaire basal au niveau des cellules lésées. Cette dépolarisation est différente entre les cellules avec et sans conduction dormante, respectivement de -57 ± 6 mV et -46 ± 5 mV. Dans les cellules à conduction dormante, cette seule élévation du potentiel membranaire basal inhibe le canal sodique entrant dépolarisant et donc la dépolarisation cellulaire. À l’inverse, l’adénosine entraîne une hyperpolarisation membranaire résultant de l’activation des canaux potassiques IK adénosine. Ainsi, l’hyperpolarisation membranaire résultant de l’injection d’adénosine peut suffire à réactiver le canal sodique dans le cas de conduction dormante. Dans les cellules ne présentant pas de conduction dormante, malgré l’hyperpolarisation secondaire à l’injection d’adénosine, la conduction ne peut être rétablie. Ainsi, l’adénosine peut être utilisée en pratique courante en salle d’électrophysiologie, au décours d’une procédure d’isolation électrique des veines pulmonaires, pour démasquer des conductions électriques dormantes, qui justifient un complément d’ablation. Rôle de l’adénosine endogène dans les arythmies cardiaques Les ectopies de veines pulmonaires sont impliquées dans le déclenchement des épisodes de fibrillation atriale. Maille et coll. (7) ont associé le taux d’adénosine plasmatique circulant (APLs) au rythme atrial sousjacent chez les patients en FA paroxystique ou persistante. Celui-ci étant plus élevé en arythmie qu’en rythme sinusal. L’équipe de Llach et coll. a quant à elle montré qu’il existait un relargage anormal de calcium par le réticulum sarcoplasmique résultant de l’hyperactivation des récepteurs A2A chez les patients en fibrillation atriale, via l’augmentation de la phosphorilation du récepteur RyR2 (8). Les récepteurs A2A et RyR2 sont deux types de récepteurs colocalisés. Ces relargages intracellulaires de calcium sont par ailleurs connus pour être le mécanisme sous-jacent des post-dépolarisations diastoliques, impliquées dans les phénomènes de trigger, déclenchant les arythmies cardiaques. Ces hypothèses électrophysiologiques sont supportées par différentes études cliniques. Chez 200 patients explorés pour une tachycardie supraventriculaire, sans antécédent de FA, Strickberger et coll. (9) ont montré que 24 (12 %) patients présentaient un épisode de FA ou flutter après l’injection d’adénosine terminant la tachycardie supraventriculaire en cours d’exploration. Parmi les autres patients, 102 (58 %) présentaient des ectopies de veines pulmonaires. Une seconde étude (10) réalisée chez 36 patients référés pour une ablation de FA, avait montré la survenue d’ectopies de veine, d’arythmies atriales organisées ou de FA chez respectivement 26 (72 %), 1 (3 %) et 4 (11 %) patients, après une injection d’adénosine. Bertolet et coll. (11) ont aussi évoqué que l’élévation de l’APLs, résultant de l’ischémie myocardique, pouvait être le trigger des arythmies atriales dans ce contexte. Ainsi malgré des données encore manquantes, l’adénosine semble être parfois impliquée dans la survenue des épisodes de FA, notamment en favorisant les activités déclenchées, principalement au niveau des veines pulmonaires. Adénosine et syncope Rôle de l’adénosine dans les syncopes neuro-cardiogéniques - Mécanismes physiopathologiques L’activation du récepteur A1 a des effets chronotrope, dromotrope et inotrope négatif. Du fait d’une concentration importante en récepteurs A1 hypersensible, au niveau du NAV, comparativement au nœud sinusal, l’effet chronotrope négatif s’exprime surtout au niveau du NAV. En parallèle l’activation des A2A et des A2B est responsable d’une relaxation artérielle. Les récepteurs A1 présentent la plus grande affinité pour l
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page précédente
- Page 2
- Page suivante