Publié le
Lecture 16 mins
Cardiologie pédiatrique : du dépistage in utero à l'âge adulte
J.-B. THAMBO, hôpital du Haut-Lévêque, Pessac
Les Journées écho-Doppler cardiovasculaire de Bordeaux
La session de cardiologie pédiatrique a permis à M. Jimenez (Bordeaux) de rappeler les indications et l’utilité de l’échocardiographie cardiaque fœtale pour dépister non seulement les malformations cardiaques les plus graves qui peuvent faire recourir à une interruption thérapeutique de grossesse, mais aussi de dépister les cardiopathies congénitales afin d’améliorer la prise en charge de ces enfants dès la naissance pour leur donner un maximum de chances.
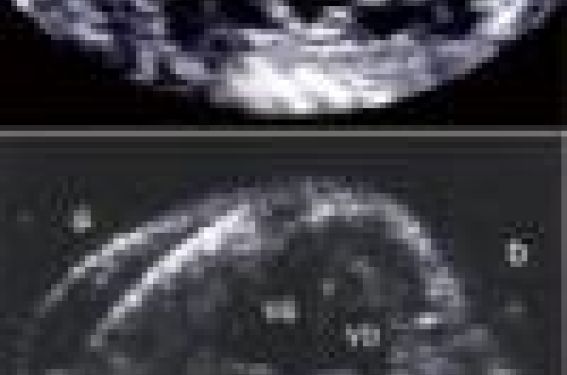
L’échocardiographie fœtale : un examen d’expert C’est une discipline qui nécessite une connaissance parfaite de l’anatomie et de la physiologie de la circulation cardiaque fœtale, mais également des cardiopathies congénitales sous toutes leurs formes. Ces éléments sont indispensables pour appréhender l’étude du cœur fœtal, donner un diagnostic précis et une conduite à tenir à nos collègues obstétriciens et radiologues, mais également conseiller et aider les parents. La performance de cet examen très spécialisé dans la détection des anomalies cardiaques fœtales dépend beaucoup du dépistage de première intention pratiqué par les gynécologues. Les buts de l’échocardiographie fœtale sont de détecter : - les cardiopathies majeures non réparables ; - les cardiopathies à haut risque d’anomalies chromosomiques ou extracardiaques associées ; - les cardiopathies nécessitant une prise en charge néonatale précoce ; - l’analyse des arythmies fœtales ; - l’évaluation de la fonction cardiaque fœtale : dysfonction cardiaque secondaire à une maladie fœto-maternelle (retard de croissance intra-utérin, jumeaux transfuseur-transfusé, etc.). L’analyse du cœur fœtal doit être séquentielle (réalisée à 18 – 20 semaines d’aménorrhée) : - position du cœur dans le thorax ; - situs auriculaire (oreillette droite recevant les veines sus-hépatiques) ; - concordance auriculo-ventriculaire (OG-VG, OD-VD) ; - concordance ventriculo-artérielle (VD-AP, VG-Ao) ; - taille du cœur et de chacune des cavités et des vaisseaux ; - taille du foramen ovale perméable et du canal artériel ; - contractilité ventriculaire. Cette analyse séquentielle et systématique doit être enseignée aux échographistes pratiquant des échographies morphologiques de premier niveau (obstétriciens, radiologues), ce qui permet d’améliorer, en créant un réseau, le taux de détection des cardiopathies congénitales. Le diagnostic exact et le pronostic de la malformation sont du domaine du cardio-pédiatre. Les anomalies coronaires : pathologies de l’enfant et de l’adulte A. Bozio (Lyon) nous a présenté un florilège d’anomalies coronaires de l’enfant mais aussi de l’adulte. Les nouvelles méthodes d’exploration non invasives qui existent aujourd’hui permettent de diagnostiquer assez précisément les anomalies des artères coronaires qui peuvent être acquises ou congénitales. Les anomalies acquises : à côté du syndrome de Kawasaki ou des autres artériopathies qui se rencontrent plus rarement chez le sujet jeune (Takayashu, Fabry, Tangier, mucopolysaccharidoses, artériopathie calcifiante, alcaptonurie), figurent aujourd’hui les anomalies secondaires à un geste chirurgical tels que la mobilisation ou le transfert des artères coronaires (correction artérielle de la transposition des gros vaisseaux, interventions de Ross ou de Bentall). Ces anomalies doivent être systématiquement recherchées après de telles opérations et notamment lorsque l’intervention chirurgicale initiale s’est heurtée à une anomalie congénitale de la coronaire native et en particulier un trajet intrapariétal aortique. Les anomalies congénitales s’expliquent par la complexité des phénomènes d’angiogenèse aboutissant à l’incorporation du plexus vasculaire du myocarde primitif à l’aorte pour former les artères coronaires. La classification anatomique détaillée d’Angelini (Circulation 2002) rend compte de l’extraordinaire polymorphisme anatomique et physiopathologique des anomalies coronaires. Il paraît plus simple de classer ces anomalies en fonction des problèmes cliniques rencontrés. Les anomalies associées aux cardiopathies congénitales. Elles posent le problème du diagnostic préopératoire des formes présentant un risque chirurgical ou pouvant modifier la tactique chirurgicale. L’échocardiographie est devenue la technique de base du diagnostic de ces anomalies et, malgré les pièges que comporte l’utilisation d’une technique tomographique pour l’étude d’une structure vasculaire arborescente, la qualité des informations fournies sur le plan anatomique et physiopathologique est généralement suffisante chez le nouveau-né et le nourrisson. Les nouvelles techniques d’imagerie par IRM ou scanner à haute définition viennent compléter les données ultrasonores chez le grand enfant ou l’adolescent et permettent d’éviter dans la majorité des cas une étude coronarographique systématique qui reste indispensable lorsque les données de l’imagerie non invasive sont ambiguës. On les recherchera plus particulièrement dans : – la transposition des gros vaisseaux, – les cardiopathies, – les sténoses aortiques valvulaires mais surtout supravalvulaires, – les atrésies pulmonaires à septum ouvert. Les anomalies associées aux myocardiopathies. L’hypoplasie du réseau coronaire, l’atrésie ostiale dans les myocardiopathies dilatées ou les ponts myocardiopathies hypertrophiques peuvent jouer un rôle dans la mort subite. Ces anomalies sont évoquées à l’écho-Doppler par une accélération du flux coronaire mais sont en majeure partie diagnostiqués par l’IRM. Les anomalies de naissance des coronaires peuvent être isolées. Les coronaires peuvent effectivement naître en position anormale, soit de l’artère pulmonaire, soit de l’aorte. Lorsqu’elles naissent de l’artère pulmonaire, c’est habituellement le tronc coronaire gauche qui naît du sinus pulmonaire postérieur gauche réalisant, dans certains cas chez le nourrisson, le typique « angor du biberon ». Le tableau est celui d’une dysfonction ventriculaire gauche d’apparition progressive où l’insuffisance mitrale ischémique peut être au premier plan. Initialement, tant que les pressions pulmonaires sont élevées, le flux est antérograde, puis au fur et à mesure que les pressions pulmonaires diminuent, le flux de la coronaire gauche s’inverse pour réaliser un shunt gauche-droit au niveau de l’artère pulmonaire, alimenté par le réseau coronaire droit à travers des anastomoses D/G dont l’importance conditionne le degré d’ischémie myocardique ventriculaire gauche. L’association de cette anomalie avec un shunt gauche droit hypertensif vicariant (CIA, CIV, CAP) est possible mais rare. Dans ce cas précis, la suppression de ce shunt peut entraîner une évolution myocardique catastrophique. Toutes les formes cliniques depuis le tableau de myocarde hibernant jusqu’à celui de la nécrose myocardique compliquée d’anévrisme ou de rupture pariétale sont possibles. Si l’aspect électrocardiographique est celui d’une nécrose myocardique, le diagnostic repose sur l’échocardiographie et la détection par le Doppler couleur de l’inversion du flux dans le réseau coronaire gauche, en particulier au niveau des artères septales et du shunt G/D au niveau de la zone d’abouchement dans l’AP. Le caractère asymétrique de la dysfonction ventriculaire gauche, l’existence d’une insuffisance mitrale ou la détection de zones de sclérose, en particulier sur le pilier mitral antérolatéral, sont des éléments d’orientation. Le traitement consiste à réimplanter chirurgicalement la coronaire gauche dans l’aorte pour rétablir une perfusion myocardique à deux coronaires. La ligature isolée de la coronaire anormale à son abouchement peut être bien tolérée dans les formes à bonne collatéralité et à shunt G/D important. Cette revascularisation myocardique s’accompagne dans la majorité des cas d’une régression de la dysfonction VG témoin du caractère hibernant du myocarde, mais la possibilité de lésions séquellaires définitives justifie une surveillance à long terme. L’importance de la collatéralité entre la coronaire droite et le réseau gauche expliquent les formes à bonne tolérance et à fonction VG sub-normale que l’on peut dépister chez l’adolescent ou l’adulte à l’occasion d’un bilan de souffle. Les anomalies de naissance des coronaires à partir de l’aorte, longtemps considérées comme des curiosités rares sans conséquences cliniques sont actuellement reconnues comme potentiellement dangereuses car à l’origine de morts subites. La naissance de la coronaire gauche du sinus droit (figure 1) et la naissance de la coronaire droite du sinus gauche sont les plus fréquemment rencontrées dans les morts subites du sujet jeune en particulier à l’effort. L’existence d’un ostium en fente, d’une valve ostiale, d’une naissance tangentielle ou d’un trajet intrapariétal aortique et interaortico-pulmonaire sont autant de mécanismes invoqués pour expliquer la survenue d’une ischémie myocardique paroxystique à l’origine des accidents subits. Le diagnostic peut être fait par échocardiographie Doppler couleur orientée et par scanner de haute définition. Il est fréquent que les tests de détection de l’ischémie myocardique à l’effort chez les patients ayant eu des symptômes avant l’accident subit restent négatifs. Le traitement chirurgical consiste, là encore, en une réimplantation de la coronaire anormale dans l’aorte. Il existe encore une forme de naissance anormale de la coronaire gauche du sinus droit avec un trajet intra-infundibulaire. Figure 1. Naissance anormale de la coronaire gauche (CG) à partir du sinus droit avec trajet inter-aortico-pulmonaire. Le flux de la coronaire s’éloignant du transducteur (en bleu) est détecté par le Doppler couleur car le flux est dans l’axe des ultrasons émis. AO : aorte ; AP : artère pulmonaire. Les fistules coronaro-camérales peuvent être isolées : elles constituent une communication entre une branche coronaire droite ou gauche et une cavité cardiaque, le plus souvent l’oreillette ou le ventricule droit, mais également l’artère pulmonaire, voire le ventricule gauche. Une insuffisance cardiaque peut s’observer chez le nourrisson en raison de l’hyperdébit du shunt G/D, mais une régression spontanée peut s’observer. Chez l’enfant plus grand et chez l’adulte, la symptomatologie est souvent réduite et l’auscultation montre un souffle continu. L’échocardiographie Doppler couleur est productive pour détecter la coronaire dilatée qui alimente la fistule et localiser la zone d’abouchement anormale. Certaines formes anatomiques sont accessibles
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page précédente
- Page 3
- Page suivante