Publié le
Lecture 10 mins
Évaluation échocardiographique du risque thromboembolique dans la fibrillation atriale non valvulaire
R. ROUDAUT, A. MIGNOT, P. REANT, S. LAFITTE, Hôpital Cardiologique du Haut-Lévêque, CHU de Bordeaux
La fibrillation atriale, de par sa fréquence croissante avec l’âge, devient un véritable problème de santé publique. Outre les problèmes de gestion de l’arythmie en elle-même, la présence d’une fibrillation atriale fait courir un risque thromboembolique certain, faisant évoquer l’instauration d’un traitement anticoagulant.
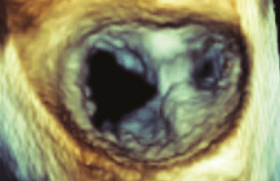
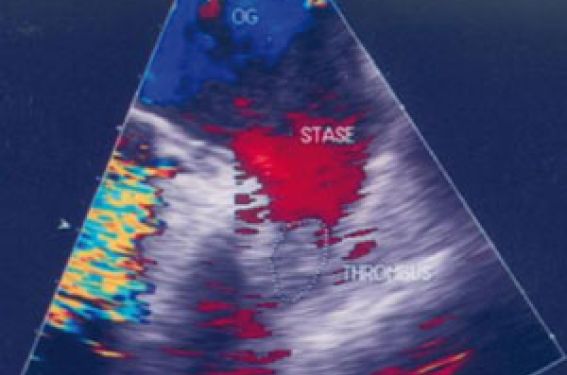
Les recommandations Cependant, tout traitement anticoagulant comporte en lui-même un risque du fait de la fenêtre thérapeutique étroite des antivitamines K, si bien que les recommandations actuellement en vigueur ne retiennent l’intérêt des anticoagulants que lorsqu’il existe des facteurs de risque thromboemboliques. Le traitement anticoagulant n’est a priori pas nécessaire s’il s’agit d’une fibrillation atriale sur cœur sain sans dilatation de l’oreillette gauche. Les recommandations actuelles de prise en charge de la fibrillation atriale (ACC/AHA/ESC : Eur Heart J 2006 ;27 :1979-2039) font appel au score clinique CHADS2 qui s’est avéré très utile pour stratifier le risque thromboembolique de la fibrillation atriale. Dans ce score, les principaux facteurs de gravité sont l’insuffisance cardiaque (CHF), l’HTA, l’Âge, le Diabète, les antécédents d’accident vasculaire cérébral (Stroke), ce dernier facteur de gravité ayant un poids supérieur aux autres et comptant pour 2 points lorsqu’il est présent. Parmi les autres facteurs de risque à prendre en compte, il faut souligner l’importance des paramètres échocardiographiques qui nous renseignent sur le ventricule gauche, l’oreillette gauche et les marqueurs de risque de thrombose intracardiaque. L’apport capital de l’échographie L’ETT En échocardiographie transthoracique, l’étude SPAF1 (Ann Intern Med 1992 ;117 :6-12) a montré à partir d’une série de 568 patients présentant une fibrillation atriale non valvulaire avec un suivi moyen de 1,3 ans, que 2 facteurs émergent : il s’agit de la dilatation de l’oreillette gauche ≥ 2,5 cm/m 2 en TM, et de l’altération de la fonction systolique appréciée par le pourcentage de raccourcissement du diamètre. Le risque thromboembolique est d’autant plus important que ce pourcentage est inférieur à 25 %. L’association dilatation de l’oreillette gauche et l’altération de la fonction de raccourcissement du diamètre identifie une population à haut risque thromboembolique : 20 % par an, alors que globalement, dans l’ensemble de la cohorte, le risque est de 5 % par an. En analyse multivariée regroupant les paramètres cliniques et échocardiographiques, les paramètres échocardiographiques représentent un facteur de risque indépendant. Dans le groupe fibrillation atriale non valvulaire sans facteur de risque clinique ou échocardiographique, le risque thromboembolique est très faible (1 % par an), il n’y a donc pas a priori de nécessité de traitement anticoagulant dans cette population. Par contre, il est à noter que dans un tiers des fibrillations atriales sans facteur de risque clinique, l’échocardiogramme est pathologique, et que dans ce groupe le risque thromboembolique > 5 % par an. Une deuxième étude, celle de Framingham (Vaziri S, Circulation 1994 ;89 :724-30) s’est également intéressée au développement d’une fibrillation atriale non valvulaire dans une population de 1924 patients âgés de 59 à 90 ans, suivis pendant 7,2 ans. Au cours de ce suivi, 154 patients (8 %) vont développer une fibrillation atriale. En analyse multivariée, trois paramètres de risque thromboembolique émergent de façon indépendante : le diamètre de l’oreillette gauche (le risque est augmenté si le diamètre en TM est ≥ 44 mm), le pourcentage de raccourcissement du diamètre, enfin l’hypertrophie ventriculaire gauche évaluée par la somme des épaisseurs du septum et de la paroi postérieure, le risque augmente si cette somme est ≥ 20 mm. Par ailleurs, il apparaît que le risque de fibrillation atriale est exponentiel si deux facteurs de risque échographiques sont réunis. Au total, les différentes études en échographie transthoracique soulignent surtout le rôle prédictif des caractères morphologiques et fonctionnels du ventricule gauche, et de la morphologie de l’oreillette gauche. Dans ces études, la fonction de l’oreillette gauche n’est guère évaluée, ce qui s’explique par le fait qu’en fibrillation atriale, il est difficile d’obtenir des données objectives de la contractilité de l’oreillette gauche (disparition de l’onde A du Doppler transmitral). De nos jours, on pourrait envisager de se baser sur l’évaluation de la fonction de l’oreillette gauche en Doppler tissulaire ou en 2D strain. Jusqu’à présent nous ne disposons pas d’étude de ce type dans la littérature, l’évaluation de la contractilité de l’oreillette gauche et de l’auricule gauche fait donc appel à l’échographie transoesophagienne. L’ETO : l’outil de choix L’échographie transœsophagienne est un outil extrêmement utile pour explorer le massif auriculaire, son ensemble et l’auricule gauche en particulier. Soulignons d’emblée que l’auricule gauche est un appendice qui est rarement unilobé, les différentes études réalisées soit au cours d’autopsie, soit par scanner, ont bien montré que l’auricule gauche est très fréquemment multilobé. Ainsi, dans l’étude de Veinot (Circulation 1997 ;96 :3112-3115) l’auricule est bilobé dans 54 % des cas, multilobé dans 80 %. L’échographie transœsophagienne s’attachera à préciser la taille de l’auricule gauche, en sachant qu’une dilatation de cet auricule > 5 cm 2 va de pair avec un risque thromboembolique plus élevé, il est également aisé d’étudier la contractilité de l’auricule au travers de la diminution de surface entre la phase de remplissage et la phase de vidange. L’étude des vélocités de l’auricule en Doppler est également extrêmement aisée à enregistrer. En rythme sinusal, on discerne très aisément une onde de vidange contemporaine de l’onde P de l’électrocardiogramme et une onde de remplissage qui fait suite. En fibrillation atriale, la morphologie est complètement modifiée. Il est très intéressant de mesurer les vélocités de ces contractions de l’auricule, en sachant que les vélocités normales sont > 60 cm/s, que dans certaines fibrillations atriales, lorsque l’oreillette gauche est très tonique, les vélocités sont conservées, mais à l’inverse lorsque l’oreillette et l’auricule sont dilatées, il existe une myopathie, ce qui va de pair avec un amortissement des vélocités qui peuvent être très faibles, de l’ordre de 10 à 20 cm/s (figure 1). Figure 1. ETO : vélocités de l’auricule gauche. Un travail de Mügge (J Am Coll Cardiol 1994 ;23 :599) avait montré que des vélocités basses 25 cm/s vont de pair avec la présence d’un contraste spontané fréquent (80 %), des antécédents d’embolie (24 %) et enfin des thrombi. Le contraste spontané correspond à des agrégats érythrocytaires, il se manifeste en échographie sous forme de nuages d’écho de faible amplitude, animés de mouvements longs et spiralés. Le contraste spontané est très fréquent, présent dans 55 % des fibrillations atriales dans l’étude de SPAFIII. Ce contraste spontané est le lit de la thrombose et de l’embolie. D’après Fatkin (J Am Coll Cardiol 1994 ;23 :961-69), il est classique d’évaluer qualitativement le contraste spontané en 4 grades : 0 = absence de contraste spontané, 1 = faible contraste spontané (échogénicité minime détectable seulement des gains optimisés, 2 = contraste spontané faible à modéré (contraste spontané non permanent au cours du cycle cardiaque, visible sans optimisation des gains), 3 = contraste spontané modéré (volutes de contraste spontané permanentes au cours du cycle cardiaque), 4 = contraste spontané sévère (échodensité intense, volutes tourbillonnant dans l’auricule, mais également souvent dans la cavité auriculaire dans son ensemble). Les travaux de Fatkin ont bien montré que la gravité du contraste spontané est corrélée aux vélocités de l’auricule, et que lorsqu’il existe un contraste spontané grade 4 ou un thrombus, les vélocités sont en règle 20 cm/s. Plus récemment, Maltagliati (Heart 2006 ;92 :933-8) a insisté sur le risque thromboembolique majeur d’un contraste spontané dense (grade 4 dense). Dans certains cas en effet, l’auricule apparaît comblé par un contraste spontané extrêmement dense, sans thrombus nettement délimité. Les auteurs dénomment ce contraste spontané dense le « sludge » (figure 2). Figure 2. ETO : « sludge » de l’auricule gauche. Le travail récent de Bernhardt (J Am Coll Cardiol 2005 ;45 :1807-1812) souligne également la gravité potentielle de ce contraste spontané dense. Cet auteur a comparé le risque thromboembolique de 2 populations de fibrillation atriale non valvulaire traitée par anticoagulants et suivis 12 mois, 128 patients présentant un contraste spontané dense de l’auricule, 146 patients présentant un contraste spontané léger. Il apparaît que le groupe contraste spontané dense est caractérisé par un taux élevé de complications (2 % d’AVC symptomatiques, 15 % d’AVC silencieux, 6 % de décès). Ceci peut avoir des implications thérapeutiques et pronostiques : nécessité d’une anticoagulation avec un INR probablement plus élevé, prudence en cas de cardioversion ou d’ablation de fibrillation atriale (sinon contre-indication). Enfin, l’échographie transoesophagienne est la méthode de choix de dépistage d’un thrombus de l’oreillette gauche ou de l’auricule. La sensibilité et la spécificité de l’ETO sont excellentes, même s’il existe certaines limites qui font que cet examen peut être mis en défaut : thrombus de petite taille, auricule très dilaté, auricule polylobé, muscle pectiné proéminent, artéfacts de réverbération (figure 3). C’est dans ces cas de doute que l’on pourrait faire appel au scanner et à l’IRM, tout en sachant que des études récentes (Kim, Am Heart J 2007 ;154 :1199-1205) montrent que le scanner fait difficilement la différence entre contraste spontané, dense et thrombus. Figure 3. ETO : petit thrombus de la pointe de l’auricule gauche. Dernier apport de l’échographie transoesophagienne, il s’agit de l’exploration de l’aorte thoracique : en effet, il apparait que la prévalence de l’athérome aortique est très élevée dans la population de la fibrillation atriale qui est une population âgée (de l’ordre de 47 %). La présence d’un athérome aortique augmente le risque de complications emboliques (multiplié par 3 à 9) chez les patients de plus 60 ans
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page précédente
- Page 3
- Page suivante