Publié le
Lecture 17 mins
Angioplastie des occlusions coronaires chroniques - Pourquoi ? Quand ? Comment ?
Y. LOUVARD, T. LEFÈVRE, A. OHANESSIAN, T. HOVASSE, J. GAROT, M.-C. MORICE, Institut CardioVasculaire Paris Sud, Institut Hospitalier Jacques Cartier
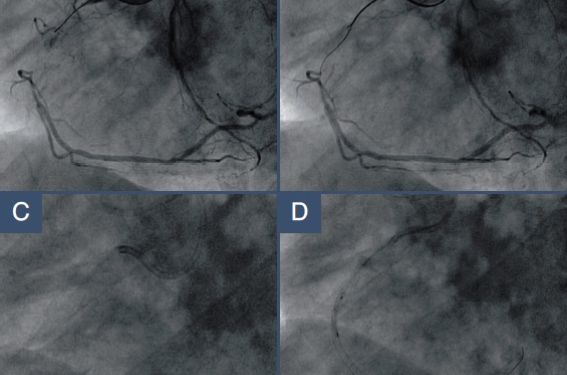
Les occlusions coronaires chroniques (CTO) ont récemment été bien définies dans un excellent article du European CTO Club(1). Il s’agit d’une occlusion coronaire totale, TIMI 0, datant de plus de 3 mois. Les CTO sont encore fréquemment traitées médicalement lorsqu’elles sont isolées ou constituent la principale raison pour le recours à une revascularisation chirurgicale chez le patient pluritronculaire(2).
Pourtant, les progrès techniques et technologiques permettent aujourd’hui d’espérer un taux de succès de l’ordre de 70 à 90 %. Les prédicteurs de succès ou d’échec sont maintenant bien connus, ce qui permet de sélectionner les patients en fonction de l’importance du vaisseau occlus, de l’anatomie de l’occlusion et de l’expérience de l’équipe. Le succès de la procédure doit être préservé sur le moyen terme par l’utilisation de stents actifs. Pourquoi désobstruer les occlusions chroniques ? On peut ranger les raisons en plusieurs rubriques : - suivre le dogme chirurgical de la revascularisation complète, au moins pour les territoires myocardiques viables ; - traiter les symptômes et l’ischémie myocardique documentée ; - améliorer le taux de survie sans événement cardiaque grave ; - améliorer la fonction ventriculaire ; - prévenir le risque de décès lors de la survenue d’un événement ischémique futur. Chez le patient pluritronculaire, l’intérêt d’une revascularisation aussi complète que possible, que ce soit par chirurgie ou angioplastie, n’est actuellement plus discuté (3,4). La très controversée étude COURAGE a montré que lorsqu’il existait une ischémie myocardique documentée significative (5), l’angioplastie coronaire associée au traitement médical optimal était supérieure au traitement médical seul. Cette étude a eu au moins le mérite de rappeler que l’angioplastie permet de traiter non seulement les symptômes, mais aussi d’améliorer l’ischémie myocardique documentée dont la valeur pronostique n’est plus controversée. Ainsi, il n’y a pas de bonne raison médicale à délaisser une CTO avec ischémie myocardique significative. Le développement d’une circulation collatérale, souvent considéré comme suffisant pour éviter l’ischémie, en réalité ne protège que très rarement de l’ischémie myocardique à l’effort (moins de 10 % des cas), comme l’a montré élégamment Werner avec l’étude des pressions distales sous adénosine (6). La viabilité myocardique peut être étudiée de façon plus fine avec l’IRM, par l’absence ou la faible épaisseur de prise de contraste tardive et la préservation de l’épaisseur myocardique, qu’avec la scintigraphie qui souvent sous-estime l’importance des territoires viables (7). Il a également été montré que l’absence d’ondes Q était un critère fiable de viabilité (8). Nous ne disposons pas d’études comparant de façon randomisée une tentative de désobstruction de CTO avec un traitement médical bien conduit. Par contre, de nombreuses études de grande taille ont montré qu’en cas de succès de désobstruction d’une CTO (9-11), le risque de décès, d’événement cardiaque majeur et le besoin d’une chirurgie de pontage étaient diminués de manière significative. La fonction ventriculaire gauche ne peut bien sûr être améliorée que lorsqu’elle est anormale à l’état basal. L’amélioration de la cinétique segmentaire après désobstruction d’une CTO est prévisible lorsque l’épaisseur myocardique est normale ou la prise de contraste myocardique en IRM 75 % de l’épaisseur du myocarde (12) ou encore, lorsqu’il existe une amélioration de la fonction segmentaire sous dobutamine à faible dose (13). Enfin, lors de la survenue d’un syndrome coronaire instable, la présence d’une CTO (14) qui, bien sûr, n’est en rien responsable de l’instabilité aggrave le pronostic non seulement à la phase aiguë (plus de choc cardiogénique, plus d’élévation enzymatique, plus de décès, etc.), mais aussi au suivi avec un risque de mortalité multiplié par 3 à 1 an en cas de CTO. Quand tenter une désobstruction de CTO ? Les prédicteurs de succès de désobstruction d’une CTO (tableau 1) ont été largement étudiés. Ils dépendent non seulement de l’ancienneté et de l’aspect anatomique de l’occlusion mais aussi de l’expérience de l’opérateur ou de l’équipe. Ce dernier facteur est difficile à mettre en évidence, en dehors d’une très longue période d’observation, les progrès étant lents, associés aux évolutions techniques et au caractère de plus en plus complexe des lésions traitées au fur et à mesure que l’expérience augmente (figure 1). Le scanner coronaire peut être une aide intéressante pour prédire et augmenter les chances de succès car il permet de repérer le trajet de l’occlusion, de mesurer sa longueur précise (15), d’évaluer l’importance des calcifications (en particulier celles comblant complètement l’ancienne lumière) et le degré de remodelage négatif du vaisseau. L’ancienneté de l’occlusion est souvent difficile à déterminer mais dans ce cas le pourcentage de succès est plus bas que lorsque l’occlusion peut être datée (16). Figure 1. Évolution de la complexité et du taux de succès de recanalisation des CTO à l’Institut CardioVasculaire Paris Sud. L’indication de tenter une désobstruction dépend donc de la qualité de l’indication clinique (viabilité + ischémie, taille du territoire ischémique, l’IVA plus que la coronaire droite ou la circonflexe), des chances de succès liées notamment à l’opérateur et bien sûr au contexte global du patient (âge, activité, motivation, fonction rénale et autres comorbidités). Le matériel et les techniques Innovations techniques Des progrès techniques et technologiques considérables sont apparus ces 10 dernières années dans le traitement des CTO. En ce qui concerne les cathéters guides, nos confrères japonais privilégient l’usage de cathéters 8 F pour leur support, les trous latéraux pour préserver le flux et ont conduit à l’apparition de formes nouvelles (variations des formes Amplatz, en particulier). Certains de ces cathéters mesurent seulement 80 cm de long pour bénéficier d’une longueur supérieure des cathéters ballons pour les approches rétrogrades. Les ballons coaxiaux sont réapparus pour permettre un meilleur support du guide, des injections distales de produit de contraste et un échange rapide des guides. Dans le même ordre d’idée, les microcathéters ont l’avantage sur les ballons coaxiaux d’un meilleur profil et de l’absence de kinking lors des échanges de guide ainsi que la présence d’un marqueur distal permettant de connaître précisément la position du cathéter. La principale innovation vient cependant des nouveaux guides durs (1), provenant essentiellement du Japon (gamme ASAHI ; tableau 2). Leur dureté est mesurée en grammes (force nécessaire pour plier le guide). La dureté du guide, accentuée par la proximité d’un support, n’est pas la seule qualité intéressante de ces guides qui ont un torque exceptionnel, et pour certains, sont effilés ou recouverts d’un polymère hydrophile. La dureté de ces guides atteint en Europe 12 grammes. Le Tornus est un instrument « vissable » (en sens inverse des aiguilles d’une montre) qui sert essentiellement à franchir les lésions dures après passage du guide mais échec de passage du ballon. Particularités techniques La stabilité du cathéter guide. La procédure commence par la stabilité du cathéter guide obtenue avec des cathéters guides de 8 F, des formes particulières (Amplatz pour les deux vaisseaux), des techniques de support actif en 6 F (compatibles radiale), des techniques d’ancrage du cathéter guide avec deux guides, ou en utilisant un ballon gonflé dans une petite branche proximale à l’occlusion (possible en 6 F seulement avec deux ballons monorails ou un ballon monorail et le nouveau microcathéter Finecross ® de Terumo), voire avec un Tornus si la lé sion est partiellement franchie. Le cathéter 5 F dans 6 F (technique Mother and Child) de Terumo est également intéressant pour augmenter le support et délivrer les stents. Les techniques de franchissement de la lésion avec le guide font appel dans les cas les plus simples à des guides hydrophiles maniés avec beaucoup de prudence. L’usage des guides durs se fait, selon les opérateurs, soit en utilisant des guides de dureté progressive, soit en choisissant un guide adapté à la difficulté (guide dur d’emblée pour les lésions calcifiées). La forme du guide revêt une grande importance, avec une forme distale marquée extrêmement courte destinée à pénétrer l’occlusion elle-même et une forme un peu plus proximale destinée à cheminer dans le vaisseau proximal ou à changer de chenal en cas de dissection. La présence d’un ballon coaxial ou d’un microcathéter permet d’utiliser une ou les deux formes (attention la puissance du guide est fortement augmentée en présence d’un cathéter coaxial ou d’un microcathéter). La stratégie de franchissement est le plus souvent une stratégie multiguide, l’échange étant facilité par l’utilisation de ballons coaxiaux et microcathéters, commençant par un guide 3 g puis si nécessaire en progressant vers des guides plus durs. La technique pour avancer le guide à travers l’occlusion fait appel au drilling, mouvements de rotation rapide de la forme distale, ou à la pénétration (orientation puis poussée du guide), les deux techniques étant souvent complémentaires. Lorsque le guide pénètre une branche collatérale, sa position intraluminale pourra être confirmée par une « mini » injection dans le matériel coaxial (ballon ou microcathéter), la partie proximale de l’occlusion pourra être prédilatée, puis un second ou le même guide sera poussé dans le lit distal en passant au plus près de la carène de la bifurcation qui est généralement indemne de lésion (figure 2). Si la branche est importante un guide classique sera laissé en place afin de la garder ouverte ou la traiter au moment du stenting de la branche principale. Si le guide est poussé dans une fausse lumière, il est préférable de le laisser en place et d’utiliser un second guide pour retrouver le bon chemin (technique parallel wire). Dans certains cas, les deux guides peuvent être supportés par deux matériels coaxiaux (cathéter guide ≥ 7 F). Les guides très durs et effilés peuvent être utilisés pour faire des réentrées de la fausse lumière vers la vraie lumière (Confianza ou Confianza Pro hydrophile 9 ou 12 g). Lorsque l’artère est disséquée, mais avec un flux antérograde, un guide hydrophile manié prudemment peut permettre de retrouver la
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante