Publié le
Lecture 11 mins
Syndrome coronaire chronique selon l’ESC 2019
Antoine VAILLIER, Thomas CUISSET, CHU la Timone, Marseille

De nouvelles directives de la Société européenne de cardiologie (ESC) ont été publiées en 2019 pour le diagnostic et la gestion de ce que l’on appelle à présent les syndromes coronariens chroniques (SCC). Elles ont mis à jour les recommandations de 2013 avec comme principale nouveauté une terminologie actualisée, la place prépondérante des tests couplés à l’imagerie et la personnalisation du traitement antithrombotique.
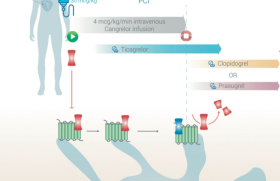
Dénomination L’ancienne appellation de « maladie coronaire stable » a été complètement actualisée pour s’appeler désormais le « syndrome coronaire chronique ». Cette nouvelle nomenclature semble plus cohérente avec le « syndrome coronaire aigu ». Elle reflète aussi le fait que la maladie coronaire est en réalité un processus dynamique d’athérosclérose et d’altération de la fonction artérielle qui évolue tout au long de la vie du coronarien. Elle peut donc être stable pendant une période mais aussi devenir instable lors d’un événement athérothrombotique. Un syndrome associant plusieurs types de patients Les recommandations identifient à présent 6 types de patients appartenant au SCC et illustrant son hétérogénéité : – les patients avec un angor symptomatique et/ou une dyspnée, – les patients développant une insuffisance cardiaque et suspects d’atteinte coronaire, – les malades avec antécédent de SCA et/ou de revascularisation il y a moins d’1 an, – les malades ayant eu un geste de revascularisation il y a plus d’1 an, – les patients suspects d’atteinte microvasculaire ou de vasospasme, – les sujets asymptomatiques qui ont pu être dépistés. Stratégie diagnostique De la même façon que les recommandations de l’ESC émises en 2013, l’approche diagnostique se fait step by step et comprend 6 étapes (figure 1). Figure 1. Approche diagnostique en cas d’angor et/ou dyspnée. À l’issue de ces étapes, des thérapies adaptées pourront être initiées notamment en ce qui concerne le mode de vie, le traitement antithrombotique et la revascularisation myocardique. ÉTAPE 1 : clinique et symptômes Cette première étape doit identifier l’âge, le sexe, les facteurs de risque cardiovasculaire et caractériser les symptômes (angor jugé typique, atypique ou non coronaire). Son objectif primordial est d’éliminer un syndrome coronaire aigu caractérisé généralement par un angor d’effort sévère de survenue récente ( 2 mois), un angor crescendo ou un angor de repos persistant. ÉTAPE 2 : comorbidités et autres causes de symptômes Il faudra évaluer l’état général, les comorbidités et la qualité de vie du patient afin de savoir si le diagnostic de coronaropathie et surtout son traitement, comprenant une revascularisation, peuvent avoir un intérêt. Cette étape permettra également d’identifier d’autres causes non cardiaques expliquant la symptomatologie afin d’envisager d’autres explorations. ÉTAPE 3 : bilan de 1 re intention Les tests de première intention comprennent un bilan sanguin (NFS, créatinine, bilan lipidique, HbA 1c et une troponine en cas de suspicion de SCA), un ECG 12 dérivations et une échographie cardiaque transthoracique. ÉTAPE 4 : évaluer la probabilité de maladie coronaire La probabilité prétest se calcule selon l’âge, le sexe et la typicité de la douleur (tableau 1). Les recommandations ont intégré la dyspnée en tant que symptôme suspect de maladie coronaire. La probabilité prétest a été révisée en se basant sur la prévalence de coronaropathie retrouvée par 3 cohortes importantes publiées récemment. La prévalence en 2019 est inférieure à celle des recommandations de 2013, ce qui entraîne une probabilité prétest en moyenne plus basse expliquant que le coroscanner a pris plus de place dans ces recommandations car indiqué chez les patients à faible probabilité prétest (PTP 15 %). Il s’ajoute désormais, à la probabilité prétest, de nouveaux critères comprenant les facteurs de risque cardiovasculaire, les modifications de l’ECG, la dysfonction VG, une épreuve d’effort anormale et la présence de calcium coronaire au coroscanner qui permettent de définir, au final, une « probabilité clinique de coronaropathie » (figure 2). Figure 2. Éléments à prendre en compte dans l’évaluation de la probabilité finale de coronaropathie. ÉTAPE 5 : choix du test diagnostique (figure 3) Figure 3. Choix du test diagnostique. Le choix du test diagnostique dépend de la probabilité clinique de coronaropathie mais également des caractéristiques des patients influençant la performance des examens, de l’expertise locale et de la disponibilité des examens (classe I-C). Les tests d’ischémie associés à l’imagerie et le coroscanner sont les examens de première intention. L’ECG d’effort a été rétrogradé et devient un examen de deuxième intention et garde surtout un intérêt dans l’évaluation du contrôle des symptômes sous traitement, la tolérance à l’exercice et le profil tensionnel. Le coroscanner par sa capacité d’exclusion de la maladie ( rule out) est l’examen à réaliser en cas de probabilité faible de coronaropathie (PTP 15 %) chez des patients qui permettent une bonne acquisition d’image (absence de calcification, d’obésité, d’arythmie, etc.) et sans antécédent de maladie coronaire (classe I-B). Les tests fonctionnels couplés à l’imagerie montrent un intérêt par la détection de l’ischémie myocardique ( rule in) et aussi de la viabilité myocardique dans l’optique d’une revascularisation. Ils sont donc à privilégier chez les patients avec une probabilité de coronaropathie élevée (PTP > 85 %ou pour guider une revascularisation myocardique (classe I-B). La réalisation d’une coronarographie d’emblée ne trouve sa place que lorsque la probabilité de coronaropathie est très élevée avec des symptômes sévères réfractaires au traitement médical et aussi en cas de dysfonction VG. La revascularisation devra être guidée par FFR en cas d’absence de test d’ischémie préalable sauf si sténose > 90 % (classe I-B). ÉTAPE 6 : évaluation du risque d’événement ischémique Ces dernières recommandations insistent sur l’importance d’évaluer le risque d’événement ischémique à chaque patient. En effet, il semble primordial d’identifier les patients à haut risque d’événement pour lequel il faudra privilégier une stratégie invasive car ils représentent ceux qui tireront le plus de bénéfice à une revascularisation tant sur le plan pronostique que fonctionnel. Ils correspondent aux patients symptomatiques avec dysfonction ventriculaire gauche et/ou test d’ischémie positif et/ou coroscanner avec atteinte sévère proximale tritronculaire, du tronc commun ou de l’IVA proximale et/ou coronarographie avec FFR 0,80. Traitement anti-ischémique Le choix du traitement antiischémique dépendra à la fois de la fréquence cardiaque, de la pression artérielle et de la FEVG (figure 4). Figure 4. Traitement anti-ischémique. Le traitement de choix reste les bêtabloquants et/ou les inhibiteurs calciques que l’on peut associer en cas de symptômes résistants à une monothérapie (classe I-A). Les bêtabloquants sont recommandés chez les patients avec dysfonction VG. Les nitrés arrivent en seconde ligne et sont à réserver en cas de symptômes réfractaires (classe IIa-B). Prévention des événements La maladie coronaire étant en perpétuelle évolution, il est primordial de mettre en place des thérapies de prévention intensive chez ces patients, en agissant notamment sur le mode de vie et le traitement médical. Un mode de vie « sain » La mise en œuvre d’un mode de vie « sain » en plus du traitement médical est le fondement sur lequel bâtir la prévention de la maladie coronaire. Il faudra favoriser le sevrage tabagique, un régime alimentaire équilibré, la perte de poids (objectif IMC 25 kg/m 2) et une activité physique (30 à 60 minutes d’activité modérée régulière). Les patients peuvent être orientés vers des équipes multidisciplinaires qui pratiquent une approche cognitive, comportementale et psychologique afin de les aider à modifier leur mode de vie. Concernant le traitement hypolipémiant, en cas d’objectif de LDL non atteint, un traitement par ézétimibe peut être ajouté à une statine à dose maximale, avec également la possibilité d’y ajouter désormais un anti-PCSK9 en cas d’objectif non atteint sous dose maximale de statines et d’ézétimibe chez les patients à haut risque cardiovasculaire (classe I-A). Chez les patients diabétiques avec atteinte multitronculaire, les inhibiteurs du co-transporteur sodium-glucose, empagliflozine, canagliflozine ou la dapagliflozine, ainsi que les agonistes des récepteurs du peptide-1-like du glucagon sont recommandés (classe I). L’utilisation d’un inhibiteur de la pompe à protons est recommandée chez les patients sous monothérapie antiagrégante, DAPT et/ou anticoagulant en cas de risque important de saignement gastro- intestinal (classe I-A). Individualiser le traitement antithrombotique à chaque patient coronarien Concernant la stratégie antithrombotique, les recommandations permettent d’individualiser le traitement antithrombotique à chaque patient coronarien. • Chez les patients en rythme sinusal, la durée de DAPT recommandée après angioplastie est de 6 mois (classe I-A) mais peutêtre réduite à 3 mois (classe IIa-A) voire 1 mois (classe IIb-C) en cas de risque élevé de saignement. Le ticagrélor ou le prasugrel peuvent également être utilisés en cas de risque ischémique élevé lié à l’angioplastie (stent sous-déployé, situation à risque de thrombose de stent, tronc commun complexe, angioplastie pluritronculaire, etc.) (classe IIb-C). À la lumière des résultats de l’étude COMPASS, les recommandations ont identifié les patients chez qui la stratégie antithrombotique devra être intensifiée. Elle concerne les patients : – à haut risque ischémique qui sont définis par : une atteinte coronaire multitronculaire associée à un diabète et/ou une récidive d’IDM et/ou un artériopathie périphérique et/ou une insuffisance rénale (DFG : 15-50 ml/min/1,73 m 2) ; – à risque ischémique modéré qui sont définis par la présence d’au moins un critère suivant : atteinte coronaire multitronculaire, diabète, IDM récidivant, insuffisance cardiaque, insuffisance rénale (DFG : 15-50 ml/ min/1,73 m 2). Dans ces deux cas, les patients doivent être sans risque hémorragique élevé (antécédent de saignement intracérébral, saignement gastro-intestinal récent, insuffisance hépatique, coagulopathie, âge extrême et insuffisance rénale sévère avec DFG 15 ml/min/1,73 m 2). Chez ces patients à risque ischémique élevé
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante