Publié le
Lecture 15 mins
Substituts valvulaires
C. CORNOLLE, CHU de Bordeaux
Plus de 300 000 prothèses valvulaires sont implantées dans le monde, dont la moitié sont des prothèses mécaniques.
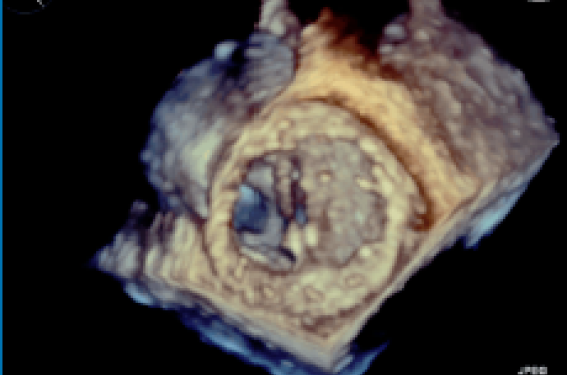
Algorithme décisionnel devant un gradient élevé sur une prothèse aortique D’après D. Mothy, Limoges Plus de 300 000 prothèses valvulaires sont implantées dans le monde, dont la moitié sont des prothèses mécaniques. Toute prothèse, quels que soient le type et la taille, présente un potentiel de complications, d’où la nécessité d’un suivi régulier clinique et échographique tout au long de la vie de nos patients (1). Des recommandations européennes et américaines précises ont été établies pour l’évaluation et la surveillance des patients porteurs de prothèse (1,2). Chaque prothèse aortique présente un certain degré d’obstruction par rapport à une valve native mais au-delà de 20 mmHg, il faut considérer cette obstruction comme anormale et entreprendre une démarche diagnostique. Cette élévation de gradient transprothétique doit systématiquement être confrontée aux données cliniques et comparée aux échocardiographies antérieures ainsi qu’aux valeurs de références pour chaque prothèse dans les données publiées (1). Les causes peuvent être multiples et la première étape est de distinguer s’il s’agit d’un obstacle fonctionnel (insuffisance aortique, hyperdébit ou phénomène de restitution de pression) ou, au contraire, une obstruction liée à un processus pathologique sur la prothèse (dégénérescence de prothèse, thrombus, endocardite, pannus). Cette dernière peut être évidente ou non, d’où la nécessité de répéter les échocardiographies et si besoin, d’avoir recours aux explorations complémentaires (fluoroscopie, ETO, scanner). À cet effet, la démarche diagnostique est la suivante : Calcul de l’index de perméabilité ou « Doppler Velocity Index » (DVI). - IP > 0,35, évoquer les états d’hyperdébit cardiaque ; - IP 0,25, calculer l’aire valvulaire effective (AVE) indexée à la surface corporelle du patient. Cette valeur sera comparée aux valeurs de référence pour chaque prothèse. Si l’AVE indexée est nettement diminuée par rapport aux valeurs de référence, un processus pathologique est fortement probable. Si l’AVE indexée est diminuée mais concorde avec les valeurs de référence pour ce type de prothèse, il faut évoquer un mismatch patient-prothèse (3). Le calcul du temps d’accélération aortique (TA) peut aider dans la démarche diagnostique en cas d’IP mesuré entre 0,25 et 0,35 : - TA > 100 ms évoque une obstruction liée à un processus pathologique sur la prothèse ; - TA 100 ms évoque un hyperdébit. Le mismatch patient-prothèse correspond à une disproportion entre la surface corporelle du patient et l’aire valvulaire effective de la prothèse. On considère que le mismatch est modéré lorsque l’AVE mesuré in vivo et indexé à la surface corporelle du patient est inférieure à 0,85 cm 2/m 2 (prévalence 20 à 70 %) et de mismatch sévère si elle est inférieure à 0,65 cm 2/m 2 (2 à 10 %) (3). Les conséquences d’un mismatch patient-prothèse peuvent être lourdes car elles s’associent à une augmentation de la mortalité toutes causes et à la mortalité cardiovasculaire à long terme (4). Au total, l’élévation d’un gradient transprothétique sur une prothèse aortique n’est pas systématiquement synonyme de dysfonction de prothèse. Complémentarité des images de coupes dans le diagnostic d’une obstruction de prothèse (écho-scanner) D’après J. Rousseau, Paris Le diagnostic d’obstruction de prothèse repose en premier lieu sur l’échocardiographie et se définit par une augmentation significative du gradient transprothétique : - > 10 mmHg associée à un PHT abaissé 150 ms pour une prothèse mitrale ; - > 40 mmHg associée à un IP 0,25 ou AVEI 0,5 cm 2/m 2 pour une prothèse aortique. Après avoir éliminé toute cause d’obstruction fonctionnelle, les éléments morphologiques à rechercher sont : - disparition des fuites intraprothétiques physiologiques ; - ouverture anormale ou retardée des ailettes ; - fuite massive ; - éléments mobiles anormaux. Le recours à d’autres examens complémentaires est quasi systématique du fait de l’échogénicité souvent imparfaite. Le radiocinéma de valve (ou fluoroscopie) est la méthode de référence pour les prothèses mécaniques. L’ETO, et en particulier l’ETO 3D (figure 1), est de plus en plus fréquemment utilisée grâce à sa haute sensibilité (5). Figure 1. Dysfonction de prothèse mécanique mitrale avec immobilité d’une ailette visualisée en ETO 3D. • Le scanner cardiaque apporte aujourd’hui un gain diagnostic indiscutable en particulier pour les prothèses aortiques. Il aide à la distinction entre pannus et thrombus, permet une meilleure visualisation des zones aveugles en ETT et une analyse de la cinétique des ailettes et en position fermée. De plus cet examen permet une évaluation différée en reconstruction tridimensionnelle (post-traitement). La distinction entre thrombus et pannus est souvent difficile. Plusieurs études ont tenté de discriminer les éléments diagnostiques pour l’un et pour l’autre(6). Sur le plan clinique : les thrombus surviennent plus précocement par rapport à la date opératoire, l’évolution des symptômes est plus rapide et une mauvaise anticoagulation est retrouvée. Sur le plan échographique : aspect hyper-échogène et taille plus volumineuse des thrombus. En fluoroscopie : un mouvement anormal des ailettes est retrouvé dans 100 % des cas de thrombus. Scanner cardiaque : le thrombus est une masse irrégulière, attachée aux éléments mobiles de la charnière en subou supra-valvulaire avec une anomalie du mouvement des ailettes. Le pannus est une masse semi-circulaire le long de l’anneau, de localisation souvent sous-aortique et les anomalies de mouvement des ailettes peuvent manquer. Néanmoins, l’analyse en scanner peut être limitée pour certaines prothèses du fait des artéfacts de durcissement (Bjork, Starr…) et ne détecte pas les fuites périprothétiques. Ainsi, la combinaison des examens est indispensable dans la démarche diagnostique d’une obstruction de prothèse. Fuites paravalvulaires - Diagnostic et conduite à tenir D’après B. Cormier, Paris Les désinsertions de prothèse sont une cause rare de dysfonction non structurelle. Elles concernent 2 % des réinterventions (1). On distingue : - les désinsertions précoces : survenue dans les 2 mois postopératoires, en rapport avec une fragilité des tissus, un défaut de technique chirurgicale ou un mauvais choix de taille de prothèse (plus fréquent lorsqu’il s’agit d’un TAVI, d’une prothèse sans anneau de fixation [stentless] ou sans fil de suture [suturless]). Le diagnostic de ces fuites est habituellement réalisé lors de l’échographie de contrôle systématique postopératoire ; - les désinsertions tardives : survenue plus de 2 mois après l’intervention. Dans un contexte aseptique, on évoquera les mêmes causes qu’en postopératoire précoce. Au contraire, le contexte septique évoquera très fortement un processus infectieux (endocardite, abcès de l’anneau natif). L’échographie Doppler est l’examen de choix pour faire le diagnostic de désinsertion de prothèse. Ce diagnostic est parfois très simple en cas de fuite massive mais peut être plus difficile du fait des fuites multiples, jets excentrés, des artéfacts, des réverbérations et des cônes d’ombre, notamment en cas de prothèse mécanique. Ceci souligne l’importance des arguments indirects échographiques permettant de préciser la sévérité : - augmentation du gradient antérograde en rapport avec l’hyperdébit (onde E > 1,9 cm/s et PHT normal pour la valve mitrale, vitesse télé-isthmique augmentée et PHT abaissée pour la valve aortique) ; - extension du jet en Doppler couleur > 30 % de la circonférence, largeur du jet à l’origine. La PISA n’est pas validée dans les fuites paraprothétiques. Néanmoins, une zone de convergence importante oriente vers une fuite sévère. Ainsi, une évaluation multiparamétrique est requise afin d’apprécier la sévérité de la fuite sans oublier le retentissement sur les cavités cardiaques (pressions pulmonaires). La confrontation avec les données postopératoires immédiates est également indispensable dans la démarche diagnostique. Les indications de l’ETO sont larges et l’apport de l’ETO 3D est aujourd’hui indiscutable. Il permet la différenciation entre les jets de lavage, les fuites para ou intraprothétiques, particulièrement pour les prothèses mitrales. Cet examen précise également les caractéristiques du défect (localisation, taille, délimitation, forme, situation de la désinsertion en 3D, présence de jets multiples) et l’étiologie (abcès détergé). Le scanner occupe aujourd’hui une place très importante. Il précise l’extension de l’abcès par rapport aux structures adjacentes et les trajets fistuleux. Le gold standard pour la prise en charge des fuites paravalvulaires sévères symptomatiques ou compliquées d’anémie hémolytique est le traitement chirurgical. Il propose un remplacement de la prothèse en cas d’endocardite ou une réparation de la valve prothétique en cas de désinsertion aseptique (recommandation IC) (7). Le choix de la technique dépend également de la taille de l’orifice de régurgitation, sa localisation et l’état de l’anneau natif. L’émergence des techniques percutanées permet dorénavant aux patients à haut risque de bénéficier d’un traitement curatif par fermeture de l’orifice de désinsertion. Même si le taux de succès immédiat est excellent sur les quelques séries publiées, le recul est insuffisant pour prédire le pronostic en termes de morbi-mortalité sur le long terme. Ces procédures longues, réalisées sous contrôle ETO 3D par des équipes expérimentées en cardiologie interventionnelle demeurent pour le moment « off label » et utilisent des dispositifs conçus pour la cardiopathie congénitale (Amplatzer) (8). L’indication dépend du trajet, de la taille et surtout de la localisation de la désinsertion (risque interférence entre le dispositif et les éléments mobiles de la prothèse). Elles sont néanmoins prometteuses dans un futur proche et l’avancée de la technologie (fusion imaging) tend à augmenter le succès de ces techniques, diminuer les complications et l’exposition aux
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante