Rythmologie et rythmo interventionnelle
Publié le
Lecture 22 mins
Arythmies en phase aiguë d'IDM : ce que le cardiologue doit savoir
P. MAURY, A. DUPARC et M. DELAY, CHU Rangueil, Toulouse

Les arythmies les plus diverses peuvent survenir et compliquer la phase aiguë de l’infarctus du myocarde (IDM) ; chacune nécessite une prise en charge adaptée et spécifique. Le but de cette revue est de faire le point sur l’épidémiologie, les mécanismes et la conduite thérapeutique actuellement recommandée concernant les divers troubles rythmiques rencontrés au cours des premières heures ou des premiers jours de l’infarctus.
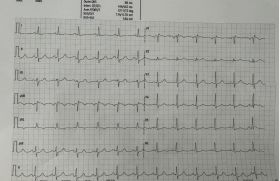
L'IDM est un terrain propice à l’éclosion des arythmies cardiaques les plus diverses qui ponctuent le déroulement de sa phase aiguë, de la simple tachycardie sinusale jusqu’à la fibrillation ventriculaire. Leur très haute prévalence est mieux connue depuis les surveillances monitorées systématiques réalisées au sein des unités de soins intensifs coronariens, puisque des arythmies peuvent être observées chez neuf infarctus sur dix au cours des premiers jours. Leur retentissement potentiel sur un état hémodynamique déjà souvent précaire et leur action délétère dans l’ischémie amènent à une prise en charge rapide, efficace et adaptée aux conditions particulières qu’impose l’infactus en phase aiguë. Mécanismes des arythmies de l’infarctus en phase aiguë L’ischémie ou la reperfusion, la nécrose ou l’inflammation tissulaire, la réaction péricardique, l’hyperadrénergie, les contraintes mécaniques, la mise en jeu de réflexes endocardiaques, les troubles ioniques, les modifications neurohumorales secondaires aux déséquilibres hémodynamiques s’associent pour engendrer bradycardies ou tachycardies. La fréquence de ces dernières s’explique par l’exacerbation temporaire des trois éléments indispensables à leur genèse, selon le schéma du « triangle des arythmies » décrit par P. Coumel, avec éclosion des extrasystoles (la gâchette), apparition de territoires myocardiques nécrosés ou ischémiques (le substrat) et déséquilibre de la balance vagosympathique (le facteur modulateur). Tous les types d’arythmies peuvent donc être rencontrés et chacune d’entre elles justifie une prise en charge particulière dans ce contexte. Les bradycardies L’apparition de signes de dysfonction sinusale ou de troubles conductifs auriculo-ventriculaires est une éventualité fréquemment rencontrée au cours des premières heures ou jours suivant un infarctus. Hypertonie vagale Une hypertonie vagale passagère, secondaire à la mise en jeu de réflexes endocardiaques de type Bezold-Jarish (activation des fibres C, chémo- et mécano-récepteurs surtout présents dans la paroi inférieure du ventricule gauche) réalise le classique syndrome de Shillingford et explique certaines bradycardies sinusales et les blocs AV paroxystiques précoces fréquemment observés, notamment dans les nécroses inférieures (7 à 50 % des infarctus inférieurs développent un BAV précoce). Ces bradycardies paroxystiques sont brutales mais temporaires, durant quelques minutes à quelques heures, et sont sensibles à l’atropine. Elles ne semblent pas avoir de signification pronostique et ne necessitent que rarement une stimulation temporaire, mais elles sont associées à une hypotension pouvant nécessiter un recours au remplissage, voire des vasoconstricteurs périphériques. Les dysfonctions sinusales Elles sont observées dans 5 % des infarctus, et leur survenue ne paraît pas être favorisée par le traitement bêtabloqueur. Mises à part celles secondaires à l’hypertonie vagale, des dysfonctions sinusales plus tardives mais plus durables peuvent se voir au décours d’un infarctus essentiellement inférieur avec extension droite, en rapport avec l’obstruction de l’artère du nœud sinusal. La vascularisation du nœud sinusal provient de la coronaire droite proximale dans 60 % des cas et du réseau circonflexe dans 40 %. Les dysfonctions sinusales sont d’origine lésionnelle et peu sensibles à l’atropine, nécessitant parfois une stimulation temporaire ventriculaire ou même atrioventriculaire. Elles régressent en général quelques jours et quasiment toujours entièrement en quelques semaines, n’ont pas de rôle pronostique à long terme et ne nécessitent en principe pas d’implantation de stimulateur définitif. Les dysfonctions sinusales sont communes, fonctionnelles par hypertonie vagale transitoire ou organiques, conséquences de l’extension de l’infarctus à l’oreillette droite. Elles sont de manière générale bien tolérées, plus ou moins rapidement régressives et ne nécessitent que rarement une stimulation temporaire ou définitive. Les blocs auriculo-ventriculaires Ils représentent, avec les ESV, la complication rythmique la plus fréquente de l’infarctus en phase aiguë. Un patient sur quatre présentera un trouble conductif auriculo-ventriculaire au cours de la première journée. Ils surviennent dans les trois quarts des cas avant la fin du 3 e jour et diffèrent en fonction de la localisation de l’infarctus et de leur date d’apparition. Il est classique d’opposer les blocs des infarctus inférieurs, fonctionnels, et en rapport avec une hypertonie vagale passagère (blocs précoces, cf plus haut), ou organiques postischémiques (blocs tardifs), et les blocs des nécroses antérieures. Les blocs tardifs compliquent 5 à 20 % des nécroses inférieures et sont plus fréquents en cas d’atteinte ventriculaire droite (40-50 %). Ils sont de topographie supra-hisienne dans l’immense majorité des cas, et peuvent être complets ou non. Ils surviennent en général après la 24 e h, de facon progressive (allongement de PR, puis bloc de type Wenckebach (figure 1) puis 2/1 qui évolue ou non vers le bloc de haut degré ou complet) et régressent de manière progressive en suivant une séquence inverse. Ces blocs sont en général bien tolérés, avec échappement stable à QRS fins et à fréquence convenable, durent plus de 48 h mais régressent totalement en 2 à 3 semaines, sans risque de récidive ultérieure, sauf en cas de récidive nécrotique ou d’extension. Ils ne necessitent de stimulation temporaire que lorsqu’ils sont mal tolérés (association à une nécrose du ventricule droit, par exemple, avec parfois necessité de stimulation séquentielle auriculo-ventriculaire) et ne justifient a priori pas d’implantation de stimulateur définitif si on a la sagesse ou l’opportunité d’attendre suffisamment longtemps. Figure 1. Bloc AV du second degré de type 1 (Wenckebach) au cours d’un infarctus inférieur en évolution. Ces blocs sont lésionnels, en rapport avec une inflammation du nœud auriculo-ventriculaire secondaire à l’ischémie. Le nœud auriculo-ventriculaire et le tronc du faisceau de His sont vascularisés par une branche de la coronaire droite distale chez neuf patients sur dix, ou par le réseau circonflexe en cas de réseau gauche dominant. Cependant, on note une prévalence importante de sténoses associées de l’IVA dans ces cas de BAV du fait de la collatéralité fréquente provenant de cette artère. En fait, les études anatomo-pathologiques ont retrouvé des lésions nécrotiques intéressant surtout le myocarde atrial supranodal et, à un moindre degré, le nœud auriculo-ventriculaire ou le tronc du faisceau de His eux-mêmes ; l’artère responsable de la vascularisation du nœud AV n’est que rarement occluse. Ces blocs ne sont pas améliorés par l’atropine (et parfois même aggravés en cas de bloc incomplet du fait de l’accélération sinusale) mais plutôt par l’aminophyline (antagoniste des récepteurs des cellules nodales à l’adénosine, synthétisée localement en réponse à l’ischémie). Ces blocs ne semblent pas avoir de rôle pronostique à long terme mais augmentent la mortalité hospitalière, notamment en cas d’association à une extension de l’infarctus au ventricule droit. Les blocs compliquant les infarctus antérieurs sont de topographie infrahisienne et de nature lésionnelle, inflammatoires ou nécrotiques. L’artère interventriculaire antérieure vascularise la branche droite et l’hémibranche antérieure gauche par ses branches septales proximales, l’hémibranche postérieure dépendant en outre pour une part du réseau coronarien droit. Ils surviennent au cours des premières heures ou jours, sont généralement précédés de troubles conductifs intraventriculaires (bloc gauche, bloc droit et hémibloc antérieur gauche surtout, voire bloc alternant) dans les minutes ou heures précédentes. Ils sont d’apparition brutale et d’emblée de haut degré, sans échappement ou avec un rythme idioventriculaire très lent, et nécessitent le plus souvent une stimulation ventriculaire temporaire en urgence, parfois même instaurée de manière prophylactique dès l’apparition de l’élargissement des QRS. Si les troubles conductifs intraventriculaires compliquent 5 à 10 % des nécroses antérieures, les bloc AV sont plus rares : un quart à un tiers des patients avec bloc de branche évolueront vers le bloc AV, soit 1 à 2 % des infarctus. Ils compliquent les nécroses antérieures étendues secondaires à une occlusion de l’IVA proximale et comportent de ce fait des taux de mortalité hospitalière et tardive élevés. Ils régressent le plus souvent en quelques jours, de manière subite, laissant cependant fréquemment persister des troubles de conduction intraventriculaire qui sont, eux, définitifs. L’évolution à distance, notamment en cas de persistance de troubles conductifs, est grevée d’une surmortalité précoce par décompensation hémodynamique et surtout mort subite, probablement au moins en partie liée aux arythmies ventriculaires en rapport avec la dysfonction ventriculaire gauche associée. La persistance du bloc doit, bien entendu, conduire à l’implantation d’un stimulateur définitif, mais, du fait des lésions myocardiques étendues, l’implantation prophylactique d’un boîtier de défibrillation (avec resynchonisation biventriculaire si besoin) doit se discuter, y compris en cas de régression partielle ou même totale des troubles conductifs. Ceci ne concerne en fait qu’un faible nombre de patients du fait de la surmortalité précoce associée à ce tableau. Enfin certains blocs auriculo-ventriculaires ou intraventriculaires peuvent régresser rapidement après désobstruction coronarienne médicamenteuse ou instrumentale, même tardive, démontrant dans certains cas leur origine ischémique pure, en cas d’infarctus antérieur ou inférieur. La thrombolyse semble avoir abaissé de manière significative l’incidence des troubles conductifs intraventriculaires (documentés à l’admission ou au cours du suivi dans 30 % des infarctus avant l’ère des thrombolytiques) ainsi que le risque de troubles conductifs atrioventriculaires
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page précédente
- Page 2
- Page suivante