Publié le
Lecture 14 mins
La plastie mitrale : quelles limites ?
C. ACAR, S. AUBERT, Hôpital Pitié-Salpêtrière, Paris
La plastie mitrale est le traitement chirurgical de choix de l’insuffisance mitrale (IM) et peut être réalisée dans une grande majorité des cas. L’utilisation systématique de l’échographie transœsophagienne en salle d’opération permet dans une large mesure d’anticiper les possibilités de plastie et de détecter les résultats imparfaits qui doivent conduire à une révision chirurgicale. L’objet de cet article est de décrire les obstacles qui limitent encore la faisabilité de la réparation et ceux qui occasionnent des complications à distance.
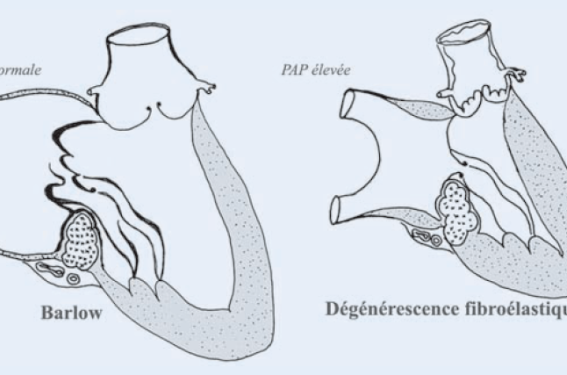
L’anatomie valvulaire défavorable L’anatomie de la valve mitrale conditionne pour une large part la faisabilité de la plastie mais également la qualité des résultats précoces et lointains. Le diagnostic lésionnel est habituellement porté avec une grande précision par l’analyse échographique et il est devenu rare de rectifier la stratégie chirurgicale au vu de découvertes opératoires. L’étiologie de la valvulopathie influence directement l’anatomie valvulaire et constitue donc un facteur pronostique majeur. L’insuffisance mitrale dégénérative Celle-ci constitue de loin la valvulopathie mitrale la plus fréquente. Une plastie est possible dans 95 % des cas environ (figure 1). Le site du prolapsus, qu’il soit monovalvulaire, localisé au feuillet postérieur ou antérieur, ou bien bivalvulaire, n’influe pas sur les possibilités de plastie. L’importance du remaniement myxoïde des feuillets ou de la dilatation annulaire ne constitue pas non plus une difficulté significative et les maladies de Barlow évoluées avec annulœctasie sont également accessibles à un geste reconstructeur. Le seul obstacle technique tient à la présence de calcifications annulaires étendues. On distingue alors deux formes anatomiques (figure 2) : - tantôt il existe un important excès d’étoffe et l’anneau mitral est fortement dilaté (maladie de Barlow). L’oreillette gauche est alors très large, ce qui facilite l’exposition chirurgicale. Le ventricule gauche est volontiers dilaté alors que la pression artérielle pulmonaire est basse, témoignant d’une bonne compensation de la surcharge volumique. La racine de l’aorte est parfois le siège d’une dystrophie débutante (élargissement du diamètre aortique, insuffisance aortique). Cette forme est favorable à la plastie et une décalcification selon la méthode décrite par Carpentier est possible dans la majorité des cas. La survie postopératoire et les résultats à distance sont excellents ; - tantôt la valve sous jacente est normale ou pellucide, hormis une rupture de cordage localisée et la dilatation de l’anneau mitral est modeste. Il s’agit habituellement de patients âgés présentant une sénescence locale de la valve (dégénérescence fibroélastique) ou de patients plus jeunes avec un long passé d’insuffisance rénale chronique (forme du dialysé). La valvulopathie s’inscrit le plus souvent dans le cadre d’une cardiomyopathie hypertensive : l’oreillette et le ventricule gauche dont la paroi est hypertrophiée sont peu dilatés, rendant plus délicat l’accès chirurgical à l’orifice mitral, et la pression artérielle pulmonaire est souvent élevée. Il n’est pas rare d’observer une maladie de Mönckeberg associée au niveau de l’orifice aortique de même qu’une athéromatose diffuse (maladie coronaire, plaques d’athérome sur l’aorte ascendante ou les carotides). Cette forme est beaucoup moins favorable, les possibilités de plastie dépendent de l’extension des calcifications annulaires et le manque d’étoffe valvulaire conduit dans la moitié des cas à un remplacement valvulaire. En raison de l’âge et des comorbidités habituelles, la mortalité opératoire et à distance est plus élevée dans ce groupe. Figure 1. Faisabilité de la plastie selon l’étiologie de la valvulopathie mitrale. Figure 2. Les deux formes anatomiques d’insuffisance mitrale dégénérative avec calcification de l’anneau mitral. À gauche : Maladie de Barlow ; à droite : dégénérescence fibroélastique. L’insuffisance mitrale ischémique L’IM fonctionnelle secondaire à une maladie coronaire ne soulève pas de difficulté technique pour la réparation. Le geste est habituellement limité à la mise en place d’un anneau prothétique de petite taille afin de compenser la restriction induite par l’excès de traction sur les cordages. Le risque opératoire, plus élevé que pour une IM dégénérative, et le pronostic à distance sont essentiellement liés au degré de dysfonction ventriculaire gauche. Ce type de plastie n’est pas exempt de complications : IM résiduelle ou récidivée (voir plus loin), insuffisance cardiaque persistante. La contre-indication anatomique la plus fréquente à la plastie pour cardiopathie ischémique est la rupture de pilier postinfarctus (figure 3). Il convient toutefois de noter que la rupture est partielle, c’est-à-dire limitée à un seul chef de pilier dans 2/3 des cas. Il est alors possible de réaliser un geste conservateur selon la technique de transposition de cordages à partir du pilier indemne. Qu’il s’agisse d’un remplacement valvulaire ou d’une plastie, il importe avant tout de rétablir en urgence la continence mitrale. À distance de l’épisode aigu, le pronostic est favorable car il s’agit souvent de patients monotronculaires. Figure 3. Deux tiers des ruptures de pilier postinfarctus sont partielles et n’intéressent qu’un seul chef. Une plastie mitrale est alors envisageable. L’endocardite infectieuse mitrale La plastie est le traitement de choix lorsque les conditions locales le permettent. En cas d’indication opératoire précoce, justifiée par une hémodynamique instable ou un risque embolique élevé, l’existence de lésions infectieuses actives multifocales envahissant largement l’étoffe valvulaire et nécessitant une résection étendue peut imposer un remplacement valvulaire. Ainsi, lorsque le contexte clinique le permet (hémodynamique, sepsis, risque embolique), il est préférable de différer l’intervention jusqu’à la deuxième semaine de traitement antibiotique. De même, lorsque l’endocardite survient sur une valve préalablement pathologique ou ayant déjà fait l’objet d’une première réparation, les possibilités de plastie sont moindres. Globalement, une chirurgie reconstructrice mitrale est possible dans deux tiers des cas à la phase aiguë de l’endocardite infectieuse. Le rhumatisme articulaire aigu et les maladies autoimmunes Ces étiologies représentent les principaux écueils de la plastie mitrale. À des degrés divers, la valve est le siège d’une double dysfonction, sténosante et fuyante, difficile à corriger complètement. Les formes principalement fuyantes (surface fonctionnelle > 1,8 cm 2) sont l’apanage des valves souples, plus fréquentes chez les sujets jeunes et volontiers accessibles à un geste de plastie mitrale. En revanche, les sténoses mitrales prédominantes (surface fonctionnelle 1,8 cm 2), pour lesquelles un traitement chirurgical est envisagé, concernent habituellement des valves remaniées car les formes anatomiques favorables sont actuellement traitées de première intention par dilatation percutanée. L’épaississement fibreux des feuillets et des cordages de même que les calcifications valvulaires représentent des contre-indications à un geste conservateur. Seulement un tiers des patients présentant une valvulopathie rhumatismale adressés à la chirurgie bénéficient d’une réparation valvulaire. La mortalité opératoire est basse dans ce groupe incluant essentiellement des patients jeunes. Toutefois, en raison de l’évolutivité des séquelles fibreuses de rhumatisme articulaire aigu, le risque de réopération à distance est plus élevé qu’en cas d’étiologie dégénérative. Les lésions mitrales au cours du lupus sont semblables à celles du RAA, hormis la présence fréquente de végétations granuleuses aseptiques (Libman-Sacks) témoignant de l’activité inflammatoire. Au cours de la maladie lupique ou du syndrome des antiphospholipides primaire, l’atteinte de l’endocarde est particulièrement évolutive et le risque de progression rapide des lésions fibreuses sur une plastie initialement non sténosante et continente est élevé. Si les signes cliniques extracardiaques ou les anomalies biologiques témoignent d’une maladie auto-immune en phase active, il est préférable d’effectuer un remplacement valvulaire par prothèse mécanique chez ces patients nécessitant dans tous les cas une anticoagulation efficace. Les échecs peropératoires Les limites de l’échographie peropératoire Le risque d’IM résiduelle après plastie a considérablement diminué avec l’avènement de l’échographie peropératoire systématique. L’échographie de contrôle doit être réalisée de façon rigoureuse en multipliant les plans de coupe afin de ne pas méconnaître une dysfonction persistante. Celle-ci est réalisée immédiatement après interruption de la circulation extracorporelle. L’état hémodynamique doit être proche de la normale, en particulier après correction d’une IM fonctionnelle dont on connaît la grande labilité avec les conditions de charge. On évitera si possible l’administration de médicaments inotropes. Il convient de restituer la totalité du volume sanguin contenu dans le réservoir de circulation extracorporelle pour assurer une précharge physiologique. Le niveau de postcharge évalué par la pression aortique systolique doit être au minimum de 120 mmHg, au besoin augmenté transitoirement à l’aide de vasoconstricteurs. Idéalement le rythme cardiaque doit être spontané (éviter l’électroentraînement) et la fréquence proche de sa valeur préopératoire en ayant soin d’éviter une tachycardie excessive qui risquerait de minimiser une fuite résiduelle. La régurgitation mitrale est quantifiée au Doppler couleur selon les méthodes habituelles. Il ne doit persister aucune fuite résiduelle ou une IM minime. La présence d’une large surface de coaptation sur l’ensemble de la ligne de fermeture témoigne d’une plastie réussie résistante aux variations des conditions de charge (hypertension artérielle, effort). Le gradient moyen transvalvulaire, est habituellement 6 mmHg. L’enregistrement d’un gradient élevé témoigne en règle d’une élévation supraphysiologique du débit cardiaque liée à une hypervolémie et isolément ne doit pas constituer en soi un critère de révision chirurgicale. Révision de la plastie La présence d’une IM de grade 2 ou plus doit faire envisager une révision de la plastie ou un remplacement valvulaire mitral. Plusieurs mécanismes peuvent être en cause : Mouvement systolique antérieur de la valve mitral (SAM) Le SAM après plastie mitrale s’accompagne souvent d’une IM parfois
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante