Publié le
Lecture 16 mins
Les HTA surrénales
M. AZIZI, Unité d’Hypertension Artérielle, Hôpital Européen Georges Pompidou, Paris
Les Journées d’HTA
Les HTA surrénales sont la conséquence de tumeurs ou d’hyperplasies avec hypersécrétion d’aldostérone (hyperaldostéronisme primaire (HAP) avec hyperplasie idiopathique ou adénome de Conn), de catécholamines (PH), ou de cortisol (syndrome de Cushing).
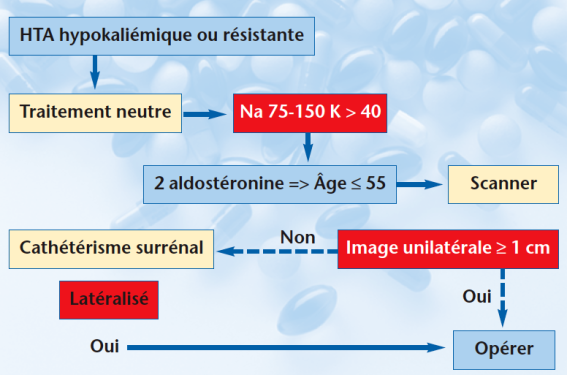
Les hyperaldostéronismes primaires Ch. Lepoutre, HEGP, Paris Prévalence et sous-types La prévalence des HAP dans les services de référence est de 6 à 13 %, environ la moitié sont des adénomes de Conn. La prévalence est moindre dans la population des patients hypertendus tout-venant (inférieure à 1,5 %) et dans la population générale (inférieure à 0,3 %). Ces adénomes sont des tumeurs bénignes ne dépassant pas 20 mm de diamètre et sécrétant exclusivement de l’aldostérone. La chirurgie de l’adénome de Conn permet de guérir l’HTA dans un tiers des cas, d’améliorer le contrôle de la PA dans un autre tiers, les échecs étant surtout liés à l’âge (guérison de l’HAP sans guérison de l’HTA). Les autres HAP sont principalement des hyperplasies bilatérales qui relèvent d’un traitement médicamenteux spécifique continu. Dépistage Les formes chirurgicalement curables sont habituellement diagnostiquées entre 40 et 55 ans. Le retard au diagnostic est fréquent, comme le montre la durée de l’HTA comprise entre 5 et 10 ans. L’HTA est souvent sévère (grade III) résistante au traitement, voire compliquée (HVG, microalbuminurie, troubles du rythme auriculaires, accidents cardiovasculaires précoces). Le dépistage de l’HAP lors du bilan initial repose sur la mesure de la kaliémie, recommandée chez tous les hypertendus. Si la kaliémie à jeun et sans garrot est 3,7 mmol/l, il faut écarter une cause digestive (diarrhée, vomissements) où la kaliurèse serait basse ( 20 mmol/j), ou une hypokaliémie iatrogène (prise de réglisse, d’alcalins, de diurétiques, de laxatifs) avant de commencer l’enquête hormonale. L’HAP n’est associé à une hypokaliémie que dans la moitié des cas mais peut entraîner une HTA résistante. La résistance au traitement est le second motif de recherche d’un HAP. Le dépistage peut aussi se faire en présence d’un incidentalome découvert fortuitement. Diagnostic positif Le diagnostic d’HAP repose sur la mesure couplée de l’aldostérone et de la rénine plasmatiques réalisée sans traitement, ou au cours d’un traitement qui ne modifie pas le système rénine-aldostérone. Il faut arrêter au moins 6 semaines la spironolactone et 15 jours les diurétiques, bêtabloquants ou antagonistes du SRA, le traitement faisant appel si nécessaire aux antihypertenseurs centraux, aux alphabloquants ou aux antagonistes des canaux calciques. En cas d’hypokaliémie, on donne une substitution potassique (comprimés de ClK) pour éviter une hyperexcitabilité cardiaque et faciliter le diagnostic : en effet, une hypokaliémie importante peut inhiber partiellement la sécrétion d’aldostérone et rendre le tableau biologique moins parlant. On vérifie, avant les contrôles hormonaux, que la kaliurèse est normale (40-80 mmol/j) pour écarter une perte digestive de potassium, et que la natriurèse est dans une fourchette adaptée aux valeurs de référence de rénine et d’aldostérone (75 à 150 mmol/j). Il y a un échappement sodé dans l’HAP, si bien qu’il n’y a pas d’œdème dans cette affection. La natriurèse reflète les apports sodés, de même que la kaliurèse reflète les apports potassiques. La consommation de sodium étant habituellement supérieure à celle de potassium, il n’y a pas d’inversion du rapport Na/K. La signature biologique de l’HAP est une aldostérone plasmatique ou urinaire élevée en présence d’une rénine basse, avec élévation du rapport aldostérone plasmatique/rénine. Compte tenu de la variabilité de la concentration plasmatique de rénine et d’aldostérone, il est utile d’avoir au moins deux mesures de ces paramètres. Les seuils diagnostiques devraient être déterminés pour chaque laboratoire en raison de la diversité des méthodes de mesure de la rénine et de l’aldostérone. Certains proposent systématiquement des tests de freination de l’hypersécrétion d’aldostérone (perfusion de sérum salé isotonique, test au captopril, etc.) dont les sensibilités et spécificités diagnostiques sont encore en cours de validation malgré leur utilisation depuis de très nombreuses années (figure 1). Figure 1. Diagramme de décision dans l’hyperaldostéronisme primaire. Les valeurs seuils proposées sont les suivantes : aldostérone/rénine > 63 pmol/mU + une concentration d’aldostérone plasmatique > 500 pmol/l en position couchée ou urinaire > 63 nmol/24 h. Les valeurs de rénine active 5 sont systématiquement arrondies à 5. Distinction entre adénome et hyperplasie Elle repose habituellement sur l’imagerie. Au cours d’un HAP confirmé, un nodule unilatéral de plus de 10 mm, ou de plus de 6 mm s’il est nettement individualisé et hypodense, est en faveur d’un adénome de Conn. Le scanner (coupes jointives de 3 mm en apnée) est la meilleure imagerie. L’IRM peut remplacer le scanner en particulier en cas de contre-indication à l’injection de produit de contraste radiologique. Quand le scanner n’est pas démonstratif, on peut aller plus loin si le patient est jeune (moins de 55 ans) ou si l’HTA est résistante. L’examen de dernier recours est alors la mesure des stéroïdes (aldostérone et cortisol) par cathétérisme des deux veines surrénales qui vérifie la latérisation de l’hypersécrétion d’aldostérone. Cet examen est de réalisation complexe (taux d’échec entre 3 et 22 %) et doit être confié à un centre spécialisé (taux de complications à type d’hématome surrénalien, d’hématome au point ponction ou de dissection surrénalienne entre 0,2 et 5 %). Certains le préconisent systématiquement avant toute intervention chirurgicale, d’autres posent des indications préférentielles en présence de petits adénomes. L’indication opératoire repose sur une nette asymétrie de sécrétion avec un rapport aldostérone/cortisol 5 fois plus élevé du côté suspect que du côté sain. Traitement Si l’adénome de Conn est confirmé, on propose au patient la chirurgie cœlioscopique en lui précisant que l’HTA n’est pas toujours complètement réversible et qu’il s’agit d’une tumeur bénigne autorisant l’abstention chirurgicale. Dans la série française de la cohorte COMETE-CONN portant sur 104 patients dont 59 femmes d’âge moyen 48 ans, opérés par cœlioscopie, la morbidité dans les 30 jours postopératoires était de 12 % (IC95 % : 6-20). La durée de séjour était de 6,3 ± 2,4 jours. La MAPA postopératoire était de 130/84 mmHg et la kaliémie de 4,2 mmol/l, le score médian de traitement passait de 2 à 1. Le taux de guérison en MAPA était de 27 % (IC : 19-37). Ainsi, la guérison n’est pas fréquente après surrénalectomie pour adénome de Conn. En revanche, il existe indéniablement une amélioration du profil tensionnel avec une diminution du score de traitement. La correction de la kaliémie est obtenue dans tous les cas. La morbidité du geste chirurgical en cœlioscopie reste modérée. À défaut d’adénome et en l’absence de latéralisation de la sécrétion d’aldostérone, le traitement est médicamenteux, utilisant un anti-aldostérone (par exemple la spironolactone). L’addition d’autres antihypertenseurs est généralement nécessaire. Le phéochro-mocytome P.-F. Plouin, HEGP, Paris Sous-types et prévalence Il s’agit d’une tumeur qui sécrète des catécholamines et qui dérive de la médullosurrénale (PH proprement dit) ou d’autres ganglions sympathiques (ces PH extrasurrénaux sont maintenant appelés paragangliomes, PGG). Les localisations les plus fréquentes des paragangliomes sont l’organe de Zuckerkandl qui est le vestige d’un ganglion chromaffine situé à la racine de l’artère mésentérique supérieure, les plexus sympathiques, la vessie, le cœur et les ganglions médiastinaux. Quant aux PGG de la tête et du cou, la plupart sont non secrétants. L’expression la plus fréquente des PH et des PGG secrétants est l’HTA, particulière par sa variabilité, la tendance à l’hypotension orthostatique et l’association d’une hyperglycémie. Un cas sur 10 est malin d’emblée et 2 cas bénins sur 10 récidivent dans les 10 ans. C’est une cause rare d’HTA (de l’ordre de 1 sur 1 000). Sa prévalence est de 4-5 % parmi les incidentalomes (figure 2). Figure 2. Diagramme de décision dans le phéochromocytome. Dépistage Il s’adresse aux hypertendus qui rapportent des céphalées, des sueurs et des palpitations et à ceux dont l’HTA est paroxystique ou associée à un diabète sans surpoids. Il peut s’agir de symptômes variables qui reflètent les effets des catécholamines alpha- et bêta-adrénergiques. Il s’adresse également aux patients ayant un syndrome familial prédisposant au PH : la neurofibromatose de type 1 [NF1], la maladie de von Hippel Lindau [VHL], la néoplasie endocrinienne multiple de type 2 [NEM2], et les syndromes PH-paragangliomes familiaux, de connaissance récente. L’une de ces quatre maladies est présente dans 30 % de l’ensemble des PH, et dans 15 % environ des cas de PH apparemment sporadiques. Enfin, la recherche d’un PH fait partie de l’enquête étiologique des « incidentalomes » (tumeurs surrénales de découverte fortuite). Diagnostic Le diagnostic positif repose sur la mesure des métanéphrines plasmatiques ou urinaires des 24 h collectées sur acide (HCl), couplée à un dosage de créatininurie. Le dosage plasmatique s’adresse aussi pour dépister les formes familiales. Le localisation du PH ou des PGG repose sur l’imagerie anatomique et fonctionnelle. L’imagerie précise le nombre, le siège et les rapports de la ou des tumeurs, et détecte d’éventuelles métastases. Les PH de l’adulte sont uniques et surrénaux dans la majorité des cas et le diamètre moyen de la tumeur est de 5 cm. Les PH sont donc faciles à localiser par échographie, scanner (tumeur hétérogène, souvent nécrotique), IRM (aspect de flash en séquence T2, rehaussement vasculaire) et/ou scintigraphie à la 123I-MIBG. Les vraies difficultés sont de ne pas méconnaître une localisation ectopique ou multiple (20 % des cas) et de diagnostiquer les PH malins sur la présence de métastases (rôle de la scintigraphie). Dans l’ordre décroissant de fréquence, les PH ectopiques ou paragangliomes siègent dans l’organe de Zuckerkandl, la vessie, les hiles rénaux, le médiastin postérieur, le péricarde et le cou. Ces tumeurs
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante