Publié le
Lecture 11 mins
Lumee™ : l’ischémie critique à l’heure du Home-monitoring
Alexandra Hauguel, hôpital Saint-Joseph, Paris
La startup américaine Profusa a mis au point en 2015 un biocapteur de mesure de perfusion tissulaire dénommé Lumee™. Comment un dispositif, d’à peine quelques millimètres d’épaisseur, compte-t-il révolutionner la prise en charge de l’ischémie critique chronique (ICC) ? L’horizon d’un stade 4 connecté.
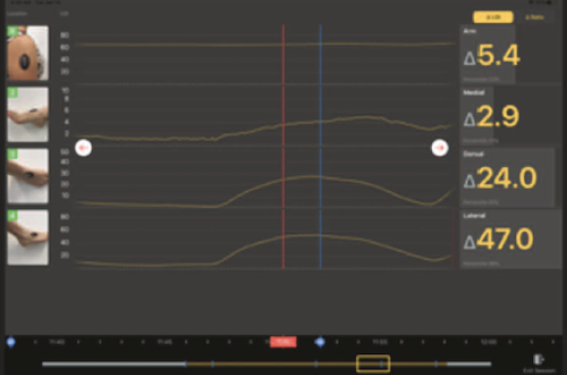
Avec une augmentation de 23,5 % de la prévalence de l’artériopathie des membres inférieurs entre 2000 et 2013, conjointement à l’augmentation de pathologies telles que le diabète et l’insuffisance rénale ainsi qu’un accroissement du nombre de patients en situation de précarité, l’ICC devient, plus que jamais, un enjeu de santé publique majeur (1). Si l’incidence précise de l’ICC reste difficile à évaluer, il est estimé qu’elle représenterait un peu moins de 10 % de l’ensemble des patients souffrant d’artériopathie des membres inférieurs. L’ischémie critique en quelques chiffres La prévalence de l’ICC aux États-Unis est évaluée à 1,3 % de la population générale et il est estimé que plus d’un million de patients atteints d’ICC ne seraient pas diagnostiqués (2). Si le nombre d’angioplasties des membres inférieurs a connu une augmentation de près de 300 % entre 1997 et 2008, le nombre d’amputations, lui, n’aurait reculé que de 4,6 % sur la même période (3). Une étude réalisée en 2015 aux États-Unis estimait à 504 000 le nombre de patients vivant avec une amputation majeure des suites d’une ICC, un nombre projeté à doubler d’ici à 2050 selon cette même étude (2). L’ICC représente un enjeu financier considérable. Le coût d’une hospitalisation d’un patient atteint d’artériopathie périphérique est 6 fois supérieur à celui d’un patient indemne d’artériopathie. L’ICC quant à elle, correspond à un des principaux facteurs de risque de surcoût d’hospitalisation, qui serait évalué à jusqu’à 5 fois plus élevé que le coût moyen de prise en charge d’un claudicant, sans compter l’impact économique de la perte d’autonomie associée, en sortie d’hospitalisation (4,5). Outre le défi d’un diagnostic positif précoce, les choix de la stratégie thérapeutique ainsi que les critères d’efficacité périopératoires et de suivi (cicatrisation des plaies) constituent encore de véritables leviers de progression en termes de prise en charge efficace de ces patients et d’économie de santé. Les limites de l’hémodynamique L’évaluation du succès intraopératoire de nos interventions repose actuellement essentiellement sur les artériographies de contrôle et nos regards finement éduqués aux nuances de gris. Or, l’on sait que l’obtention d’une revascularisation de bonne qualité artériographique, aussi instantanément gratifiante soit-elle pour le praticien, n’est malheureusement pas toujours synonyme de perfusion tissulaire satisfaisante. Plusieurs études mettent désormais en avant l’intérêt de l’évaluation des discordances entre perfusion artérielle et oxygénation tissulaire dans le but de mieux comprendre la contribution réelle du flux dans certaines complications ischémiques. L’accès à des données biologiques fines de perfusion tissulaire, notamment peropératoires, pourrait être une étape potentiellement game-changing dans la prise en charge de l’artériopathie périphérique. L’accès à ces données ultrasensibles en temps réel et de façon mini-invasive fait poindre une réelle promesse de sophistication de nos procédures. Mais ces données pourraient aussi être, en amont, une aide non négligeable concernant la décision opératoire, tant on sait que le choix entre un nième geste de revascularisation versus une surveillance active associée au traitement médical optimal peut être difficile pour ces patients fragiles, chez qui le primum non nocere prend tout son sens. De la même façon, concernant le suivi des patients présentant des troubles trophiques, aucun outil ne permet actuellement de répondre efficacement à la question du pronostic et du potentiel de cicatrisation d’une plaie, qui constitue pourtant la préoccupation centrale des patients et le critère d’efficacité principal à long terme en vue du sauvetage de membre. Les promesses de l’oxymétrie Fortes de ces constats, les dernières recommandations de bonnes pratiques concernant l’ICC de la Society for Vascular Surgery (SVS) ont récemment intégré, notamment à travers le score de stratification du risque WIfI ( Wound, Ischemia, and foot infection), la perfusion tissulaire au cœur des algorithmes de prise en charge (figure 1). Figure 1 : Wifi et stratification du risque. D’après Conte et al. (2). Comment l’évaluer efficacement en pratique ? La perfusion du tissu résulte de phénomènes complexes. À l’échelle microscopique, la distribution de l’oxygène aux tissus est déterminée par plusieurs facteurs biologiques dont la distribution des flux artériels au sein du tissu, mais aussi les capacités de transport en oxygène (taux d’hémoglobine, Hb), la saturation en oxygène de l’hémoglobine et l’efficacité de la dissociation Hb-oxygène. À l’échelle macrospique, l’état de perfusion d’un tissu dépendra, outre de la vascularisation des principaux axes artériels, également de nombreux facteurs tels que l’état nutritionnel, l’inflammation, l’œdème, la présence d’une infection, etc. Les outils d’oxymétrie actuellement disponibles sont peu nombreux et présentent des performances limitées. Le plus utilisé en clinique est l’oxymétrie transcutanée (TcPO 2), qui quantifie le potentiel d’oxygénation maximal d’un tissu, moyenné sur un volume, et simulé par une hyperhémie qui nécessite un chauffage de l’électrode entre 40 et 45 °C afin de créer une vasodilation hyperthermique. Différents tests (hyperhémie postischémique, tests posturaux, inhalation d’oxygène, tests d’effort sur tapis roulant) sont ensuite réalisés afin de s’affranchir du gradient basal d’O 2 transcutané et d’évaluer les possibilités de recrutement et de réserve hémodynamique (figure 2) (6). La mesure de la TcPO 2 présente, cependant, de nombreuses zones d’ombre et inconvénients. Figure 2 : Dispositif de TcPO 2 d’effort (6). Tout d’abord, les études menées pour juger de son efficacité sont peu nombreuses et souffrent d’un manque de puissance, de reproductibilité et d’homogénéité des critères des jugements utilisés (7). D’autre part, la précision de la mesure de la TcPO 2 est souvent techniquement compromise du fait de la présence de plaies pouvant gêner l’implantation d’électrodes, d’amputation antérieure, d’un sepsis et/ou d’oedème, de l’épaisseur cutanée, d’une oxygénothérapie concomitante ou du calibrage inconstant des électrodes. Outre l’état local, des paramètres systémiques peuvent également modifier les valeurs de la TcPO 2 comme une insuffisance cardiorespiratoire, une anémie, un syndrome inflammatoire, un diabète ou la prise de médicaments vasoactifs. Les appareils de mesure ne sont pas toujours disponibles, il s’agit d’un examen long (30 min environ) et mobilisant plusieurs équipes. Enfin, les différents tests nécessaires pour augmenter la sensibilité de la mesure sont incompatibles avec une réalisation peropératoire. Par conséquent, la place de gold standard concernant l’évaluation de la perfusion tissulaire reste à pourvoir (7). Le Lumee™ À l’inverse d’autres méthodes d’oxymétrie non invasives récemment développées pour un monitoring en temps réel, telles que l’oxymétrie pulsée, la spectroscopie infrarouge ou les technologies laser, reflétant essentiellement l’oxygénation intravasculaire, le biocapteur dénommé Lumee™ permet une évaluation directe de l’oxygénation intratissulaire du volume de voisinage immédiat. Ce petit dispositif biocompatible, de 0,5 mm de diamètre sur 5 mm de long, est délivré au tissu par une simple injection sous-cutanée par une seringue de 16 ou 18 G (figure 3). Le Lumee™ est composé d’une structure d’hydrogel au sein de laquelle sont incorporées des métalloporphyrines capables de détecter la présence d’oxygène par une réaction d’extinction de phosphorescence. L’activation du biocapteur se fait par l’envoi, par un lecteur optique apposé sur la peau, de lumière LED ( Light-Emitted Diode) pulsée. Le biocapteur Lumee™ activé par la LED émettra alors un signal de phosphorescence, directement proportionnel au degré d’oxygénation tissulaire local et mesurable par les photodétecteurs du même lecteur (figure 4). Ce signal est ensuite instantanément envoyé au logiciel du Lumee™, qui permet de suivre graphiquement, à distance et en temps réel les résultats. Figure 3 : La plateforme Lumee™ . A : Les éléments de la plateforme Lumee™ : l’hydrogel Lumee™ Oxygen, l’aiguille d’injection Lumee™ Pen, le lecteur optique sans fil Lumee™ patch, le logiciel de suivi à distance des données patients Lumee™ App. B : Insertion sous-cutanée du Lumee™. Figure 4 : Activation du biocapteur Lumee™ par LED et réception du signal de fluorescence oxygénodépendant. Une première preuve de concept chez l’homme a été publiée en 2015 démontrant la faisabilité d’un monitorage de l’oxygénation tissulaire chez des patients atteints d’ICC par ce dispositif (8). Une étude parue en 2019, comparant le Lumee™ à la TcPO 2 a montré que le Lumee™ présentait une plus grande rapidité de détection des variations d’oxygène interstitiel et détenait une sensibilité accrue de détection des phénomènes d’autorégulation microvasculaire (9). Le Lumee™ permet un accès direct à l’état d’oxygénation d’un échantillon tissulaire à son état basal, sans nécessité de recours à une hyperthermie, dont on connaît le potentiel de perturbation du réseau microvasculaire et de la consommation tissulaire d’O 2. Mais le principal avantage de ce dispositif implantable comparativement à la TcPO 2, reste avant tout la possibilité d’un monitorage continu et à distance de la perfusion tissulaire. Ce type de dispositif permettrait de s’intégrer à chaque étape de la prise en charge du patient atteint d’ICC : • En préopératoire, il pourrait contribuer au dépistage précoce et au diagnostic positif en cas de doute clinique. • En peropératoire : Le Lumee™ serait un nouveau critère de jugement d’efficacité de la revascularisation justifiant ou non le traitement d’un étage vasculaire supplémentaire. D’autre part, il pourrait contribuer au choix stratégique de l’artère cible la plus pertinente. La vascularisation des patients en ischémie critique est basée sur une collatéralité inconstante et de topographie extrêmement
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante