Publié le
Lecture 15 mins
Prise en charge endovasculaire de l’embolie pulmonaire à la phase aiguë
Basile VERDIER, Guillaume SCHURTZ, Nicolas LAMBLIN, Gilles LEMESLE, Lille*
L'embolie pulmonaire (EP) est la troisième cause la plus fréquente de décès d’origine cardiovasculaire. Le traitement de l’EP repose sur une stratification appropriée du risque pour une prise en charge adaptée(1). Les recommandations des Sociétés européenne et américaine de cardiologie codifient la prise en charge des embolies pulmonaires aiguës(2,3).
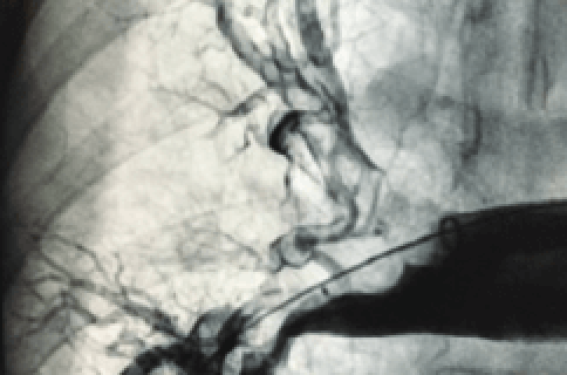
La majorité des EP (60 %) sont à bas risque, sans conséquences hémodynamiques et peuvent être prises en charge par une anticoagulation orale ambulatoire. À l’opposé, les EP graves et compliquées d’instabilité hémodynamique (état de choc ou hypotension) doivent être rapidement orientées vers des thérapeutiques de reperfusion pulmonaire, principalement par l’administration d’une thrombolyse systémique. Toutefois dans la vie réelle, seulement 30 % des patients présentant une EP avec retentissement hémodynamique reçoivent effectivement une thrombolyse, en raison des contre-indications et de la peur de la survenue d’une complication hémorragique sévère (4). Le troisième groupe de patients atteints d’EP à risque intermédiaire est le plus difficile à gérer. Il s’agit de patients présentant des signes de dysfonction ventriculaire droite (VD) à l’échocardiographie ou à l’angioscanner et des marqueurs biologiques de souffrance myocardique, mais qui ont préservé une stabilité hémodynamique (définie comme une pression artérielle systolique > 90 mmHg). Ces patients justifient d’une anticoagulation et d’une surveillance accrue durant la phase initiale en raison du risque d’aggravation. La réalisation d’une thrombolyse systémique peut devenir nécessaire en cas d’apparition secondaire de signes de choc et certains ont même suggéré de réaliser une thrombolyse de manière plus systématique justement dans l’objectif d’éviter le risque non rare d’aggravation secondaire. La thrombolyse systémique à dose complète pour l’EP à risque intermédiaire élevé a été testée dans l’étude PEITHO ( Pulmonary EmbolIsm THrombOlysis trial) (5) qui a randomisé 1 001 patients. Ceux qui ont reçu une thrombolyse ont eu une réduction significative du risque du critère composite, choc et/ou de décès (5,6 % vs 2,6 % à 7 jours), mais les complications hémorragiques de l’administration du thrombolytique ont effacé les bénéfices du traitement, créant un bénéfice clinique net neutre. L’administration d’une thrombolyse systémique multipliait par 5 le risque de saignement majeur et par 10 le risque de saignement intracrânien dans cette étude. La problématique actuelle est donc de disposer d’un traitement en alternative à la thrombolyse : d’une part, pour l’EP à haut risque avec risque hémorragique élevé (seule la thrombectomie chirurgicale était jusque-là possible), et d’autre part, pour l’EP à risque intermédiaire élevé. Dans ce dernier cas, ce traitement aurait pour objectif de réduire le risque d’évolution vers l’EP grave avec moins de complications hémorragiques que la thrombolyse permettant d’améliorer la survie dans ce groupe d’EP difficile à gérer et dont la mortalité hospitalière peut atteindre 12 % (6). Ainsi, se pose actuellement la problématique de la thrombolyse à demi-dose. L’étude PEITHO-3, randomisant les patients entre une demi dose de thrombolyse ou l’anticoagulation seule, devrait apporter une réponse à la question de savoir si les bénéfices de la thrombolyse systémique sur la prévention du choc observés dans PEITHO peuvent être préservés, tout en réduisant les risques hémorragiques par cette stratégie « demi dose ». Par ailleurs, de nombreuses approches endovasculaires se développent. Différentes méthodes sont actuellement en cours d’évaluation comprenant la thromboaspiration, la thrombectomie mécanique et la fibrinolyse in situ facilitée ou non par les ultrasons. Ces techniques souffrent pour le moment d’un manque de données cliniques, le choix étant orienté généralement par un consensus d’experts, sur des séries limitées. L’objectif de cet article est de présenter ces thérapies interventionnelles pour l’embolie pulmonaire, et d’essayer de définir leur place dans la prise en charge de cette pathologie. Principes généraux D’un point de vue purement pratique, la réalisation d’une procédure de revascularisation pulmonaire se fait par voie veineuse fémorale avec cathétérisme des artères pulmonaires. Une angiographie sélective est réalisée pour définir les sites d’intervention selon la charge thrombotique. Une analyse préalable à toute intervention de l’angioscanner thoracique est un point tout à fait critique pour guider le geste. Les dispositifs sont nombreux, se présentent sous différentes formes et repo- sent sur des principes dont l’objectif commun est de permettre une désobstruction localisée plus ou moins rapide de la circulation pulmonaire et ainsi de faire baisser la postcharge ventriculaire droite (2). À ce jour, seuls trois dispositifs sont validés par la Food and Drug Administration (FDA) : EKOS™ Endovascular System (Boston Scientific), FlowTriever ® (Inari Medical) et Indigo ® system (Penumbra). Les données scientifiques sur ces systèmes sont à ce jour modestes et ne reposent pas sur des études randomisées solides mais sur des registres ou des séries de cas rétrospectifs. Il n’existe qu’un seul essai randomisé qui s’est intéressé au système EKOS™ (7) sur lequel nous reviendrons en détails plus tard dans cet article. De plus, les données ne reposent que sur des critères de jugement indirects d’efficacité et d’amélioration de la fonction ventriculaire droite (rapport du diamètre du ventricule droit/gauche à 24 ou 48 h) et non sur des critères cliniques durs. Toutefois, les résultats encourageants des dernières études ont amené les dernières recommandations ESC à considérer ces systèmes interventionnels en grade IIa C chez les patients présentant une EP grave ou à risque intermédiaire élevé (2). Des équipes multidisciplinaires spécialisées dans l’EP ont émergé en réponse aux défis cliniques posés par des données scientifiques limitées concernant la prise en charge endovasculaire, l’évolution rapide de la technologie et un certain nombre de données parfois contradictoires pour les patients atteints d’une EP à risque intermédiaire élevé ou à haut risque (8). Inspirée du concept de Heart Team pour l’infarctus du myocarde, les chocs cardiogéniques et les syndromes aortiques aigus, cette stratégie permet une expertise multidisciplinaire impliquant les cardiologues, les pneumologues, les radiologues, les chirurgiens cardiaques et les cardiologues interventionnels. Cette prise en charge en équipe permet de limiter l’hétérogénéité de prise en charge au sein d’un même centre et par extension au sein du système de santé à l’échelle du pays, un meilleur accès à ces dispositifs pour les patients, une utilisation plus appropriée de ces techniques, une amélioration de nos résultats et une réduction de la durée de séjour des patients et donc des coûts pour le système de santé (9). Les recommandations de l’ESC de 2019 proposent donc une approche multidisciplinaire pour la prise en charge des patients présentant une EP à risque intermédiaire élevé et à haut risque au sein de structures organisées. Présentation et données des différents systèmes Thrombolyse in situ dirigée par cathéter assistée par ultrasons : le système EKOS™ Cette stratégie consiste en l’émission continue d’ultrasons sur le thrombus pulmonaire pendant une thrombolyse intravasculaire locale, in situ, afin d’optimiser la reperfusion artérielle. La délivrance par cathéter directement dans les artères pulmonaires présente les avantages théoriques de fournir une concentration locale plus élevée de l’agent fibrinolytique sur une plus grande surface du caillot et en utilisant une dose totale plus faible que l’administration périphérique. Un cathéter multiperforé est placé dans le caillot dans chaque artère pulmonaire et un agent fibrinolytique, l’actilyse, est perfusé à la posologie de 0,5 à 1 mg/heure par cathéter. La durée de la perfusion est généralement de 8-12 heures, donnant des doses totales moyennes de 25 mg d’actilyse. L’avantage de la délivrance locale est donc de limiter la dose de thrombolytiques par un facteur de 3 ou 4, avec l’arrière-pensée de limiter les complications hémorragiques. L’héparine systémique à dose efficace est bien sûr maintenue en amont, pendant et en aval de la fibrinolyse in situ. Pour tenter d’améliorer l’efficacité et la vitesse de la lyse du caillot, la fibrinolyse est combinée à des ondes ultrasonores de haute intensité et de basse fréquence. Les mécanismes de ces ondes sont discutés mais il semblerait que l’augmentation de la température locale augmenterait l’activité enzymatique du thrombolytique, le flux acoustique engendré par les ondes ultrasonores entraînerait mécaniquement l’agent actif au sein du thrombus et le maintiendrait au contact des sites de liaisons ; l’excitation acoustique du fluide crée des microbulles qui en éclatant peuvent aider à désagréger le thrombus et les ultrasons et permettraient de désagréger de manière réversible les brins de fibrine ce qui exposerait davantage de sites sur lesquels les agents thrombolytiques peuvent se fixer. Le système EKOS™ est actuellement le cathéter pour lequel le plus de données sont disponibles. Il comprend un cathéter pour l’administration de médicaments et un dispositif microsonique contenant une série de transducteurs ultrasonores positionnés le long de la zone de traitement (figure 1). En général, deux cathéters sont nécessaires par patient (EP souvent bilatérales) avec donc 2 abords veineux fémoraux 6 F. Figure 1. Le système EKOS™ (Boston Scientific). L’étude randomisée ULTIMA (n = 59 patients) a permis de montrer, par rapport à l’anticoagulation seule, pour des EP aiguës à risque intermédiaire, une diminution plus rapide du rapport VD/VG (-23 % à 24 h), sans saignement majeur dans le groupe thrombolytique. En revanche, il n’y avait aucune différence significative sur la mortalité à 90 jours dans cette étude de petite taille (7). Nycamp et coll. ont par ailleurs montré dans une étude rétrospective de 45 patients une réduction des pressions pulmonaires à la fin du traitement par le système EKOS™ chez des patients hémodynamiquement instables (40,2 % de réduction) (10). Dans le registre SEATTLE II, ayant inclus 150 patients, les données ont été confirmées en montrant de nouveau une réduction
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante