Publié le
Lecture 11 mins
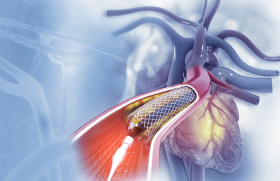
Les endoprothèses à libération de paclitaxel
A. OHANESSIAN et O. VARENNE, hôpital Cochin, Paris

Parmi les drogues actives sur la resténose utilisées dans les endoprothèses à libération de drogues actives, seulement deux molécules sont, à l’heure actuelle, commercialisées et validées par de grandes études : le sirolimus (stent CypherTM, Cordis) et le paclitaxel (stent TaxusTM, Boston Scientific).
Qu’est-ce que le paclitaxel ? Le paclitaxel provient de l’écorce et des aiguilles d’un arbre, un if du Pacifique : le Taxus brevifolia, isolé pour la première fois en 1967. Cet agent a été initialement développé par le US National Cancer Institute comme chimiothérapie et a été approuvé par la FDA en 1992 comme traitement anticancéreux. Le paclitaxel possède des propriétés permettant de prévenir la resténose après mise en place d’un stent endocoronaire. Il inhibe la prolifération et la migration des cellules musculaires lisses impliquées dans la resténose et limite l’inflammation. Il possède également, à faibles doses, une action plus sélective sur les cellules musculaires lisses, sans retarder la réendothélialisation. Il est liposoluble et est donc rapidement absorbé par la paroi vasculaire. Le paclitaxel favorise la transformation, dans le cytoplasme cellulaire, de tubuline en microtubules stables (polymérisation), rendant les microtubules non fonctionnels et donc inhibant la division cellulaire, la mobilité, la migration, la transduction et la sécrétion cellulaire impliquées dans la resténose. Le paclitaxel sans polymère Les premiers essais cliniques ont été réalisés avec des stents en acier recouverts directement de paclitaxel sans adjonction de polymère. Le contrôle de l’action et de la dose même de la drogue est aléatoire et le résultat à très long terme reste inconnu. À ce jour, trois études ont été publiées utilisant des stents recouverts de paclitaxel sans polymère : les études ASPECT (étude de sécurité et efficacité) ELUTES et DELIVER. ASPECT ( Asian Paclitaxel-Eluting Stent Clinical Trial) Cette étude, réalisée dans trois centres, a inclus 177 patients avec des lésions coronaires 15 mm de long dans des artères de 2,25 à 3,5 mm de diamètre. Les patients ont été randomisés dans trois groupes : - un groupe recevait le stent Cook recouvert de la faible dose de 1,3 µg/mm 3 de paclitaxel ; - le deuxième groupe a reçu le stent Cook recouvert d’une forte dose de 3,1 µg/mm 3 ; - le troisième groupe, témoin, a reçu le stent Cook nu. L’objectif principal, le pourcentage de resténoses angiographiques à 6 mois, a été réduit significativement dans le groupe à forte dose de paclitaxel (14 % versus 23 % en cas de faible dose, et 39 % dans le groupe témoin). Le nombre de revascularisations a été équivalent dans chaque groupe, ainsi que le nombre de patients indemnes d’événements. Il est à noter que, dans cette étude, Plavix ® ou Ticlid ® (majoritaire) a été interrompu au bout d’un mois dans 2 des 3 centres, sans que l’on ait observé de thrombose tardive. Le bénéfice angiographique ne s’est donc pas traduit par un bénéfice clinique. ELUTES ( European evaLUation of pacliTaxel Eluting Stent) Il s’agit d’une étude d’évaluation de doses qui a inclus 192 patients ayant une lésion monotronculaire 15 mm de long (type A ou B1). Le stent utilisé était le V-flex Plus ® (Cook) recouvert de paclitaxel sans polymère à 4 doses différentes : 0,2, 0,7, 1,4 et 2,7 µg/mm 3. L’objectif primaire, le pourcentage de sténoses intrastent (% DS) à 6 mois, a été réduit dans le groupe forte dose de 14 % ( versus 23 %, 27 %, 33 % et 34 % dans les groupes à plus faibles doses et le groupe témoin, respectivement). La perte de gain a été de 0,11 mm dans le groupe forte dose et 0,73 mm dans le groupe témoin, réalisant une resténose binaire à 6 mois de 3,2 % dans les stents recouverts de forte dose de paclitaxel contre 14 % dans les groupes 0,7 et 1,4 µg/ mm 3, et 20 % dans les groupes à faible dose et placebo. Comme dans l’étude précédente, les taux d’événements ont été similaires dans chaque groupe. Ces résultats encourageants nécessitaient la confirmation d’un grand essai randomisé contre stent nu avec bénéfice clinique. DELIVER I ( Drug Eluting coronary stent systems In the treatment of patients with de novo native coronary lesions) Dans cette étude, 1 041 patients (dont environ 30 % de diabétiques) avec une lésion monotronculaire (2,5 à 4 mm de diamètre) ont reçu une endoprothèse Achieve ® (Guidant) recouverte directement de paclitaxel, selon le procédé mis au point par Cook ®, ou un stent Penta ® (Guidant). À 240 jours, la perte de gain et le taux de sténoses ont été plus faibles en cas de mise en place de stents actifs. Le taux de resténoses angiographiques du groupe stent coaté avec 3,0 µg/mm3 a été à peine plus faible que dans le groupe stent nu (17 % vs 22 %) sans différence statistiquement significative ni réduction des gestes de revascularisation justifiés cliniquement (5,2 vs 6,8 % à 270 jours et 6 vs 7,6 % à 1 an). Le taux global d’échecs de la revascularisation est ainsi réduit de 18,8 % de façon non significative (9,4 vs 7,5 %, p = 0,315). Le nombre de thromboses de stents durant cette étude a été bas (0,4 % dans les deux groupes). En raison de ces résultats décevants, le programme de développement des prothèses directement recouvertes de drogues actives a été interrompu par Guidant. Le manque de polymère empêche le contrôle de la délivrance de la drogue active. Dans ELUTES et ASPECT, seule la dose de 3,0 µg/mm 3 a des résultats probants sur la sténose angiographique ; la dose est trois fois supérieure à celle utilisée dans les études TAXUS. En outre, ces deux études n’ont pas montré d’effet positif du stent Cook ® recouvert directement de paclitaxel sur les événements cliniques. Le seul gain sur le pourcentage angiographique ne peut remplacer un bénéfice clinique en termes de revascularisation chez les patients, ni effacer les interrogations non résolues sur les effets à long terme. L’abandon de ce programme par Guidant et l’utilisation de polymères dans les programmes de développement de CypherTM et du stent TAXUS ® , ainsi que les programmes bien avancés FUTURE et ENDEAVOR, rendent très peu probable un quelconque avenir des stents actifs sans polymère. Pourquoi utiliser un polymère ? Le paclitaxel a des propriétés dose-dépendantes et intervient sur toutes les phases de la resténose. La possibilité de contrôler la dose et la diffusion du produit dans le temps est indispensable pour assurer la sécurité et l’efficacité d’un stent actif et pour obtenir des résultats plus constants avec un risque moindre d’effets secondaires. La société Boston Scientific a développé un polymère, Translute™, biocompatible et compatible avec le vaisseau (il n’entraîne pas de réaction inflammatoire), n’altérant pas les propriétés mécaniques de l’endoprothèse. Ce polymère contient le paclitaxel et permet de contrôler sa libération dans la paroi artérielle coronaire. Différents protocoles ont été testés : 4 doses et 3 modalités différentes de relargage de la drogue (lente, modérée et rapide) dépendant des concentrations de polymère. La dose minimale de paclitaxel réduisant la formation néo-intimale sans toxicité locale est de 1 µg/mm 3 (3 000 fois moins que les doses utilisées en chimiothérapie) : à cette faible dose, l’action reste locale et non systémique. La dose de 1 µg/mm 3 avec relargage lent a été étudiée dans TAXUS I (étude de faisabilité) avec 0 % d’événements cardio-vasculaires à 30 jours et à 6 mois, et la dose de 1 µg/mm 2 avec relargage modéré dans TAXUS II. Le programme TAXUS Le stent TaxusTM dérive de la plate-forme ExpressTM sur laquelle est appliqué un polymère contenant le paclitaxel. Les caractéristiques physicochimiques du polymère permettent de contrôler la libération du produit actif (Boston Scientific). Après l’étude de faisabilité TAXUS I, les études de sécurité et d’efficacité ont été lancées. L’étude TAXUS II a eu pour but d’évaluer, chez 538 patients, deux formules de relargage, lent (SR) et modéré (MR) du stent TaxusTM (figure) (Boston Scientific) versus stent NIR ® nu sur des lésions de novo (3 et 3,5 mm de diamètre, une seule longueur de stent de 15 mm). L’objectif principal de l’étude a été de mesurer par échographie endocoronaire le volume de prolifération néo-intimale intrastent à 6 mois. Après 6 mois, les stents actifs TaxusTM réduisent : - le volume de prolifération intrastent de 64 % (7,9 % versus 23,9 %), - le taux de resténoses binaires de 73 % (SR) et de 74 % (MR), le taux d’événements (MACE) à 6 et 12 mois de 50 % (SR) et de 54 % (MR), - le taux de revascularisation de la lésion stentée de 64 et 76 %. Les résultats obtenus sont en phase avec ceux observés dans les études déjà publiées avec le sirolimus. L’efficacité similaire de ces deux formulations suggère que la dose seuil de 1 µg/mm 3 avec un relargage lent permet d’interrompre la cascade de la resténose pour les lésions coronaires à bas risque. L’étude TAXUS III a évalué, dans un essai non randomisé, le stent TaxusTM (NIR ® 15 mm, 3-3,5 mm de diamètre) dans le traitement de la resténose intrastent. Chez les 30 patients inclus, 14 ont eu 2 stents et 16 un seul stent. Le taux de resténoses à 6 mois a été de 16 % en angiographie. Si l’on exclut les deux cas de resténose survenue au niveau d’un gap laissé entre deux stents posés et le cas de resténose dans un stent nu (posé après un stent TaxusTM), ce taux peut être ramené à 4 %. L’échantillon était petit et permet difficilement de tirer des conclusions formelles. Néanmoins, cela reste très encourageant et met, une fois de plus, en valeur le fait qu’il est indispensable que deux stents actifs se chevauchent sans laisser de gap. TAXUS IV est la plus large étude du programme. Il s’agit d’un essai randomisé en double aveugle ayant pour but d’évaluer la sécurité et la supériorité de TaxusTM slow release sur le stent ExpressTM nu ; 1 326 patients ont été inclus dans 73 centres américains. Les critères d’inclusion comprenaient une monolésion mesurant de 10 à 28 mm de long sur une artère native de 2,5 à 3,75 mm de diamètre. Les critères d’exclusion comprenaient un infarctus du myocarde 72 h, une dysfonction VG (FEVG 25 %), une lésion du tronc commun, une lésion ostiale, des lésions avec calcifications modérées à moyennes, une lésion de la bifurcation, une occlusion ou l’existence d’un thrombus endocoronaire. Le
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante