Publié le
Lecture 16 mins
Traitement endovasculaire percutané des anévrismes de l’aorte abdominale sous-rénale (AAA) - Il faut garder le triple A !
J.-M. PERNES, M. AUGUSTE , P. DUPOUY, F. BARBOTIN, H. BORIE, S. KOVARSKY, D. HOVASSE, Pôle CardioVasculaire Interventionnel 92, Hopital Privé Antony
« Priez Dieu de graisser votre girouette afin qu’elle puisse s’orienter au vrai vent de l’Esprit, et qu’elle ne reste pas calée par la rouille des vaines habitudes » Pierre Céserole
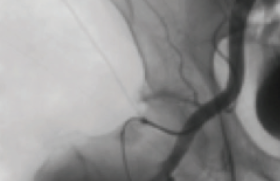
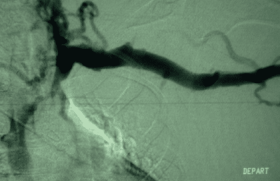
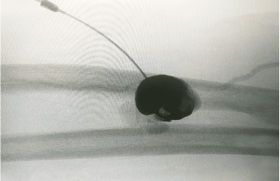
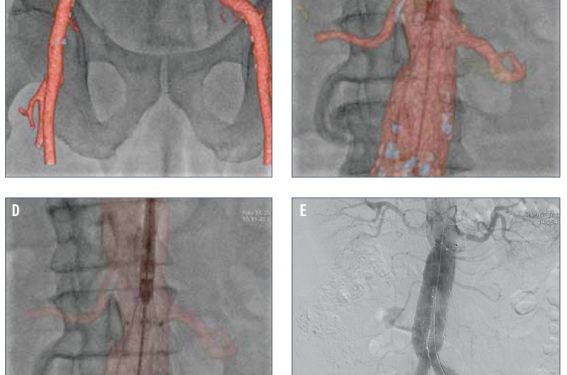
La Doxa Rappelons qu’il n’existe pas de définition univoque d’un anévrisme de l’aorte abdominale (AAA) : pour Johnston et al., l'AAA est une dilatation permanente et localisée de l'aorte de plus de 50 % par rapport au diamètre normal attendu, avec une perte du parallélisme de ses bords, en forme de sac (anévrisme sacciforme) ou plus souvent de fuseau (anévrisme fusiforme) ; le diamètre normal de l’aorte est alors une donnée fondamentale qui dépend de l’âge et du sexe. D’autres définitions ont été utilisées : pour Cronenwett et al., un anévrisme de l’aorte abdominale sous-rénale est un élargissement de son diamètre antéropostérieur ou transverse de plus d’une fois et demie celui de l’aorte inter-rénale alors que Collin et al. ont proposé la définition suivante : « Un AAA est défini par un diamètre externe maximal de l’aorte sous-rénale supérieur à 4 cm (en valeur absolue), ou supérieur de 0,5 cm au diamètre de l’aorte abdominale située entre l’origine de l’artère mésentérique supérieure et celle de l’artère rénale gauche ». L’absence de définition consensuelle aurait pu introduire un manque de rigueur dans l’analyse de la littérature concernant les AAA. En réalité, le risque évolutif d’un AAA a été essentiellement étudié par rapport à son diamètre externe maximal, valeur communément utilisée pour établir le taux de croissance, le risque de rupture d’un AAA et définir les indications chirurgicales. L'incidence des AAA augmente avec l'espérance de vie. On estime que 2 à 6 % de la population de plus de 65 ans est atteinte d'AAA. La prévalence varie en fonction du diamètre de l'anévrisme pris en compte et de la population étudiée (âge, sexe, facteurs de risque vasculaire). Elle augmente chez l'homme et avec l'âge (Albert Einstein et Charles De Gaulle avaient respectivement 76 et 80 ans lorsqu'ils furent mortellement foudroyés par la rupture de leur anévrisme !). La croissance progressive d’un AAA est inéluctable, mais le rythme de cette croissance est difficile à prévoir chez un patient donné. Grâce aux méthodes de diagnostic et de suivi, la chirurgie est programmée de plus en plus précocement. Ceci permet d'éviter la rupture qui est une forme évolutive évaluée à 7 pour 100 000. D’une manière générale, les gros anévrismes augmentent plus rapidement de diamètre que les petits anévrismes. Dans l’étude de Limet et al., les anévrismes de 3 à 3,9 cm de diamètre augmentaient en moyenne de 0,53 cm par an, et ceux de plus de 6 cm de 0,8 cm par an. Qu’elle soit considérée comme linéaire ou exponentielle, cette croissance expose au risque de rupture. Ce risque est d’autant plus élevé que le diamètre de l’anévrisme est large : il est estimé à 5 ans à 10 % au-dessous de 4 cm, à 25 % entre 4 et 7 cm, à 45 % entre 7 et 10 cm, à 60 % au-dessus de 10 cm. Le but du traitement des AAA est donc de prévenir la rupture. Les deux techniques de traitement des AAA La chirurgie par mise à plat greffe Cette technique avec ouverture du sac anévrismal et implantation d’une prothèse synthétique tubulaire ou bifurquée, a une mortalité périopératoire actuellement inférieure à 5 % dans la majorité des séries d’AAA non rompus. La mortalité augmente de façon importante, jusqu’à 15 %, chez les malades à risque chirurgical élevé. Cette chirurgie peut être combinée au traitement de lésions associées des artères viscérales. Le traitement des anévrismes de l’aorte abdominale par chirurgie laparoscopique est une nouvelle technique actuellement en cours d’évaluation. Le traitement par la mise en place d’une endoprothèse par voie endovasculaire Au milieu des années 1990, le traitement des anévrismes de l’aorte abdominale par la mise en place d’une endoprothèse par voie endovasculaire a été proposé comme alternative au traitement classique par chirurgie ouverte (EVAR dans la littérature anglo-saxonne, pour Endo Vascular Aneurysm Repair). Le principe du traitement endovasculaire des AAA repose sur l’exclusion de l’anévrisme à l’aide d’une endoprothèse introduite par voie fémorale et fixée aux parois artérielles d’amont et d’aval à l’aide de stents. Suite aux premières recommandations nationales de l’Afssaps en 2001, elle était initialement réservée aux patients considérés comme à risque chirurgical élevé (c’est-à-dire présentant un des facteurs suivants : âge supérieur ou égal à 80 ans, coronaropathie – antécédent d’infarctus de myocarde ou angor avec test fonctionnel positif –, insuffisance cardiaque avec manifestations cliniques patentes, rétrécissement aortique serré non opérable, FEVG 40 %, insuffisance respiratoire chronique, insuffisance rénale si créatininémie > 200 μmol/l, abdomen hostile), porteurs d’un AAA d’au moins 5 cm de grand diamètre ou ayant augmenté d’au moins 1 cm au cours de la dernière année. La réévaluation en 2009 par la HAS du rapport bénéfice/risque a permis de lever la restriction aux patients à haut risque. Le traitement par voie endovasculaire peut être actuellement proposé en première intention comme la chirurgie aux patients à risque chirurgical normal et critères anatomiques favorables et après information des patients des bénéfices et des risques des deux méthodes. Seuls les AAA sous-rénaux asymptomatiques dont le plus grand diamètre est supérieur à 5 cm ou a augmenté de 1 cm en 1 an peuvent être traités. Le traitement ne peut être proposé à un patient à risque chirurgical normal qu’à la condition que les critères anatomiques suivants soient respectés : – collet sans thrombus circonférentiel ni calcifications majeures ; - collet proximal à bords parallèles > 15 mm ; - angle du collet proximal : 40° ou compris entre 40° et 60°, à la condition de bénéficier d’une longueur de collet supérieure à 20 mm. Le diamètre du collet proximal, l’état du collet distal (point(s) d’ancrage iliaque (s)), les accès iliofémoraux doivent être compatibles avec le système de pose et l’endoprothèse utilisée. À noter que la mise en place d’une endoprothèse chez un patient à risque chirurgical normal ne doit pas entraîner l’exclusion volontaire d’artère(s) viscérale(s) fonctionnelle(s) y compris l’artère hypogastrique, en dehors de l’artère mésentérique inférieure. Le rapport de l’Afssaps de 2009 spécifie que la pose d’une endoprothèse aortique (EPA) ne doit être envisagée que dans un centre pluridisciplinaire regroupant des activités chirurgicale et radiologique. Ce centre doit avoir une pratique régulière de la chirurgie vasculaire, des thérapeutiques endovasculaires et des explorations radiologiques à visée vasculaire. La collaboration radiochirurgicale est éminemment souhaitable. La salle où se déroule la pose doit répondre à des critères de qualité chirurgicale permettant une intervention majeure et radiologique (traitement numérisé de l’image avec un mode soustraction, matériel de cathétérisme, injecteur de produit de contraste, respect des contraintes de radioprotection du personnel). La surveillance du patient à long terme est obligatoire et sous la responsabilité de l’implanteur. La surveillance doit satisfaire au calendrier suivant : en postopératoire immédiat ou dans les 30 jours, aux 6 e et 12 e mois postopératoires, puis annuellement, en l’absence de complication. Les résultats des essais randomisés mettent en évidence une diminution significative de la mortalité précoce (à J30) par rapport à la chirurgie conventionnelle avec une fourchette de 4,6 à 4,7 % dans le groupe chirurgical (CHIR) versus 1,2 à 1,7 % dans le groupe traité par voie endovasculaire. Cet avantage disparaît à moyen terme pour la mortalité toutes causes (20,2 % dans le groupe CHIR versus 18,4 % dans le groupe ENDO. La dernière publication d’EVAR 1 intègre des patients supplémentaires par rapport à la publication de 2005 (inclus entre janvier et août 2004) et repose sur une durée de suivi minimale de 5 ans et maximale de 10 ans (durée médiane de 6 ans). La mortalité toutes causes est de 7,5 décès pour 100 patients-années dans le bras ENDO versus 7,7 dans le bras CHIR. La mortalité spécifique AAA est de 1,0 décès pour 100 patients-années dans le bras ENDO versus 1,2 dans le bras CHIR. La mortalité spécifique est plus faible dans le bras ENDO dans les 6 premiers mois, mais elle s’accroît très fortement après 4 ans (HR = 4,85). Ces nouveaux résultats établissent que la mortalité spécifique aux AAA converge entre les deux techniques à 6 ans (contre 2 ans pour la mortalité toutes causes). La publication de DREAM rapporte des données avec un suivi de 6 ans. Le taux de survie est de 69,9 % dans le bras CHIR et 68,9 % dans le bras ENDO (p = 0,97). L’efficience : une nouvelle variable incontournable dans la pratique médicale En 2001, le marché se limitait à trois endoprothèses aortiques (EPA) (Zenith ®, Ancure et AneuRx ®). Ces EPA que l’on peut qualifier de 1re génération, ne sont plus sur le marché, à l’exception de l’endoprothèse Zenith ® (Cook Medical). Six endoprothèses sont maintenant disponibles sur le marché français : Talent LPS, Endurant ® (Medtronic) Powerlink (Endologix), Excluder ® (Gore), Zenith ®, Anaconda™ (Terumo) et inscrites sur la LPPR (Liste des produits et prestations remboursables) dans la liste des DMI facturables en sus des GHS. Le système principal (corps bifurcation + jambages) est au tarif de 5 831 euros. Les modules d’extension, de conversion et d’obstruction, sont au tarif de 1 127 euros. En 2009, le nombre d’endoprothèses bifurquées ou aorto-uniiliaques recensées en France dans la base LPPAM est de 1 045. En décembre 2010, la HAS a été saisie par le Comité économique des produits de santé (CEPS), rappelant que l ’ indicat ion actuelle retenue pour les EPA est fondée sur une analyse de leurs risques et bénéfices et ne prend pas en compte leur coût relatif par rapport à une intervention chirurgicale conventionnelle. L’intervention endovasculaire se distingue de la chirurgie par certains aspects qui peuvent entraîner des différences de coûts dont il faut mesurer l’ampleur, que ce soit au moment de l’intervention initiale ou dans le suivi des
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante